Доказательства и возможные механизмы редкой вертикальной передачи SARS-CoV-2

Оригинал: Evidence and possible mechanisms of rare maternal-fetal transmission of SARS-CoV-2
Автор: C. Egloff et al.
Опубликовано: Journal of Clinical Virology (07.2020) online 18.05.2020
Перевод: Елена Алексеенкова, Фонд профилактики рака
Аннотация
Инфекция, вызванная SARS-CoV-2, распространилась по всему миру, но на данный момент еще мало информации о естественном течении заболевания у беременных и риске передачи инфекции от матери плоду. Судя по имеющимся на настоящий момент данным, в материнской крови концентрация вирусной РНК низкая, и отсутствуют достоверные свидетельства инфекционного поражения плаценты вирусом SARS-CoV-2. Предполагается, что перинатальная передача SARS-CoV-2 возможна, но происходит редко. Среди 179 обследованных на SARS-CoV-2 при рождении детей, у чьих матерей был подтвержденный диагноз COVID-19, в 8 случаях можно было подозревать передачу инфекции ребенку: у 5 новорожденных был положительный результат ОТ-ПЦР на SARS-CoV-2 при исследовании мазка из носоглотки, а у 3 выявлены IgM к SARS-CoV-2. Однако эти случаи были связаны с заболеванием матери, симптомы которого проявлялись при поздних сроках беременности, и пока нет информации о последствиях инфекции во время первого или второго триместра беременности. Для определения частоты и факторов риска перинатальной передачи SARS-CoV-2 необходимы хорошо спланированные проспективные когортные исследования со строгими критериями оценки.
Введение
Пандемия, вызванная коронавирусом SARS-CoV-2, началась в Китае в конце 2019 года и быстро распространилась по всему миру. Этой эпидемии предшествовали эпидемии ТОРС (связанного с SARS-CoV-1) и MERS [1]. Цель обзора — сообщить и прокомментировать точки зрения вирусологов и акушеров-гинекологов по поводу возможной передачи SARS-CoV-2 от матери ребенку и потенциальном влиянии вируса на перинатальные исходы и более отдаленные последствия.
Виремия у матери
Во время первичной инфекции присутствие вируса в крови даже в течение непродолжительного времени — важная предпосылка для передачи инфекции от матери плоду трансплацентарным путем.
В время предыдущих эпидемий ТОРС примерно у 78 % пациентов вирусная РНК обнаруживалась в крови в течение недели после появления симптомов. Виремию определяли с использованием количественного ПЦР-исследования на РНК SARS-CoV-1 с пределом обнаружения в плазме 74 копии/мл. Вирусная нагрузка в плазме у пациентов с умеренными симптомами была низкой, со средней концентрацией 140 копий/мл, близкой к порогу обнаружения [2, 3]. Исследования SARS-1 были выполнены с использованием оптимизированных методов, в то время как усовершенствование методов для выявления SARS-CoV-2 в крови все еще ведется [4].
У пациентов с COVID-19 вирус SARS-CoV-2 может не обнаруживаться методом ПЦР в образцах из ротоглотки. В двух когортных исследованиях, в которые были включены 205 и 40 пациентов, в плазме крови вирусная РНК была обнаружена только у 1 % и 15 % пациентов соответственно [5, 6]. Наконец, немецкие исследователи недавно сообщили о невозможности выделить патогенный вирус из крови пациентов с COVID-19 [7]. Использование более чувствительных ПЦР-систем для определения РНК SARS-CoV-2, таких как описанная недавно, способная выявить виремию в 11/80 образцов от 15 ранее отрицательных (0/80) пациентов, должно повысить степень обнаружения вируса в крови, как происходило с его обнаружением в образцах из носоглотки [8]. Применение новой системы позволило установить in vitro взаимосвязь между количеством патогенных вирусных частиц и количеством копий вируса, которое в настоящее время оценивается в 1,8 TCID50 (приблизительно 4 инфекционных частицы на 11 копий [95 % доверительный интервал: 7,2–52,6 копий]). По недавно опубликованным данным, в группе 50 пациентов с COVID (78 % — мужчины) обнаружение виремии с использованием ОТ-ПЦР в реальном времени по протоколу ВОЗ было значительно выше при более тяжелом течении заболевания (60% против 88%) [9]. По данным этого исследования, медиана вирусной нагрузки в плазме крови составляла от 100 до 500 копий/мл, соответственно. Однако у одного пациента вирусная нагрузка превышала 10^4 копий/мл. Эти данные о вирусной нагрузке в плазме будут иметь неоценимое значение при оценке риска внутриутробной передачи вируса, когда тест станет доступным и сможет применяться для исследования образцов крови беременных.
Недавно с помощью метода глубокого секвенирования вирусная РНК была обнаружена в мононуклеарах из бронхоальвеолярных смывов, но в моноцитах периферической крови ее наличия не было выявлено у 2 из 3 обследованных пациентов [10]. Кроме того, на лимфоидных клеточных линиях (MT2 и A3.01) было показано, что вирус может проникать в лимфоциты, но этот процесс не имел дальнейшего развития [11].
Таким образом, вирусная РНК SARS-CoV-2 присутствует в крови, но в очень малых количествах, и связь этого факта с вероятностью передачи инфекции остается неясной. В другом исследовании не удалось продемонстрировать репликацию вируса после непосредственного инфицирования моноцитов крови высокой инфекционной дозой вируса SARS-CoV-2 (MOI 10, то есть 10 вирусных частиц/клетку) [11, 12]. Наоборот, авторы описали постепенное снижение количества вирусной РНК внутри клетки с течением времени. Однако эти результаты еще следует прояснить, поскольку, например, вирус Чикунгунья не может инфицировать моноциты периферической крови in vitro, но неоднократно наблюдалось временное присутствие вируса в моноцитах и B-лимфоцитах в крови пациентов и при инфицировании ex vivo цельной крови людей, а также на животной модели макак [13]. Эти данные предполагают, что частота выявления и титры РНКемии у пациентов, инфицированных SARS-CoV-2, могут быть ниже или практически эквивалентны тем, что наблюдаются у пациентов, инфицированных SARS-CoV-1. Кроме того, вирус, по-видимому, к репликации в циркулирующих моноцитах не способен, либо способен, но на очень низком уровне, что согласуется с данными о SARS-CoV-1 [14]. Эти результаты еще предстоит подтвердить после оптимизации методов исследования для обнаружения вируса в плазме крови.
Для сравнения, другой представляющий интерес для акушерства вирус — вирус Зика — в крови беременных женщин может обнаруживаться многократно или даже непрерывно (аналогичный результат — на животных моделях), в то время как у небеременных пациенток вирус в крови может быть выявлен только в острый период заболевания (менее одной недели) [15].
Происходит ли трансплацентарная передача SARS-CoV-2?
Также передаче инфекции от матери плоду может способствовать тропизм вируса к плаценте — инфицирование клеток плаценты и, таким образом, преодоление вирусом плацентарного барьера. На момент написания данной статьи не было опубликовано ни одного случая инфицирования плаценты SARS-CoV-2. В пяти публикациях методом ОТ-ПЦР были исследованы в общей сложности 7 плацент от пациенток с COVID-19; SARS-CoV-2 не был обнаружен ни в одном из образцов [12, 16, 17, 18, 19]. Кроме того, при гистологическом исследовании трех плацент не было выявлено какого-либо значительного поражения [16].
В пользу гипотезы о том, что инфицирования плаценты не происходит, может свидетельствовать тот факт, что рецептор SARS-CoV-2 — ангиотензинпревращающий фермент 2 (ACE2), — необходимый для проникновения вируса в клетку, во время первого триместра беременности обнаруживается в плаценте в очень низких количествах [20]. При этом данные об экспрессии ACE2 в плаценте во втором и третьем триместрах отсутствуют. Однако у крыс на модели артериальной гипертензии, индуцированной высокосолевой диетой, продемонстрирована экспрессия мРНК и значительная ферментативная активность ACE2 в матке и плаценте на поздних сроках беременности (день 19–20). В силу этого, возможность инфекционного поражения плаценты незадолго до родов и, следовательно, потенциальная вероятность трансплацентарной передачи инфекции плоду требуют дальнейшего изучения [21].
Авторы двух исследований сообщают об обнаружении вируса в околоплодных оболочках в критически тяжелых случаях в третьем триместре беременности методом ПЦР [22][перевод] и, что более интересно, с помощью электронной микроскопии [23], но ни у одного новорожденного в течение первой недели жизни не была выявлена инфекция.
Другой путь проникновения вируса через плацентарный барьер — перенос через него инфицированной клетки крови. Однако SARS-CoV-2, если и может проникать в моноциты периферической крови, по-видимому, не способен к репликации в них, как SARS-CoV-1 [24]. С другой стороны, резидентные макрофаги лимфатических узлов или селезенки могут экспрессировать ACE2 (клетки ACE2+, CD169+ или CD68+), и у пациентов в терминальной стадии заболевания вирус был обнаружен в этих клетках (нуклеокапсид — иммуногистохимическим методом), но не был выявлен в Т- или В-лимфоцитах [25]. SARS-CoV-1, который также использует рецептор ACE2, был обнаружен в альвеолярных макрофагах [26].
Хотя, судя по данным, вирус не реплицируется внутри моноцитов, и эти клетки не способны переносить патогенный вирус, тем не менее, в макрофагах лимфатических узлов и селезенки могут содержаться вирусные частицы. Этот факт акцентирует внимание на необходимости исследования клеток Кащенко–Гофбауэра – макрофагов децидуальной оболочки и плаценты.
Следующий механизм передачи вируса через плаценту — трансцитоз опсонизированного или свободного вируса, как продемонстрировано для ВИЧ. Но этот механизм остается весьма гипотетическим ввиду низкого уровня виремии, о котором упомянуто выше [27].
Наконец, передача некоторых вирусов, таких как вирус простого герпеса, ВПЧ и ВИЧ, может происходить восходящим путем при контакте с вирусом или инфицированными им клетками в шейке матки или влагалище. Этот тип передачи особенно относится к инфекциям, передаваемым половым путем. Только одно исследование оценивает возможность выявления SARS-CoV-2 методом ОТ-ПЦР во влагалищном отделяемом 10 женщин, и во всех образцах результат исследования на вирус был отрицательным [28].
Инфекция плода и новорожденного: выявление прямым (ПЦР) и непрямым (серологическим) методом
Пока данных об инфекции SARS-CoV-2 у новорожденных очень мало, и они противоречивы. Исследования, опубликованные на сегодняшний день, имеют очень малые выборки. Некоторые исследователи не обнаружили свидетельств инфекции у новорожденных при изучении образцов плаценты, амниотической жидкости, пуповинной крови и мазков из глотки новорожденных. Также предположение о вертикальной передаче может быть сделано на основании выявления IgM у некоторых новорожденных, чьи матери были инфицированы SARS-CoV-2.
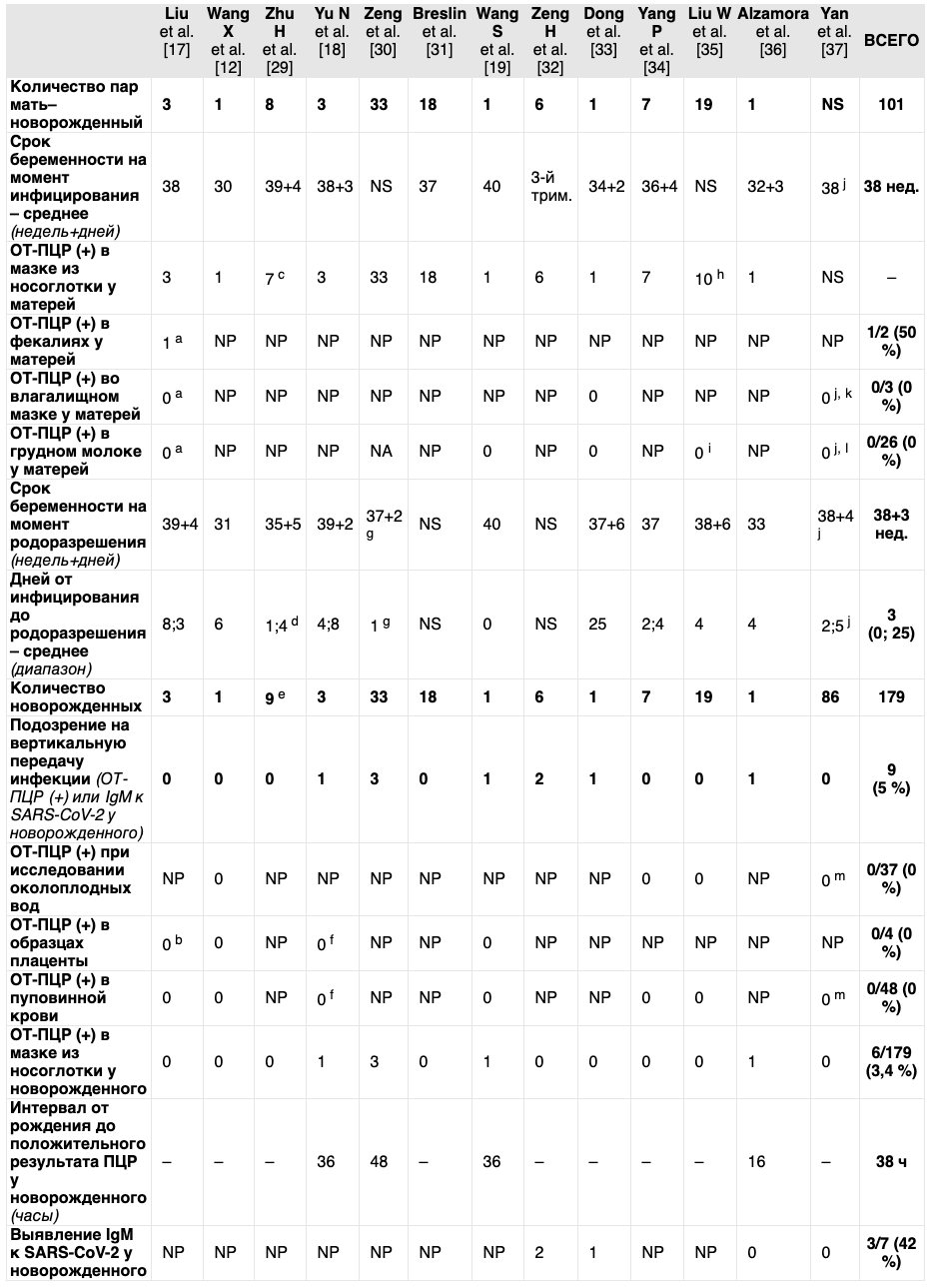
В опубликованных данных описано 179 случаев обследованных на SARS-CoV-2 новорожденных, матери которых были инфицированы в третьем триместре беременности [12, 17, 18, 19, 29, 30, 31, 32, 33, 34, 35, 36, 37]. Заболевание у всех пациенток развилось на поздних сроках беременности, и они были госпитализированы в течение нескольких дней после инфицирования (среднее значение: 3 дня; диапазон: 0–25 дней). Исследование методом ПЦР проводили в образцах околоплодных вод и пуповинной крови в 37 и 48 случаях, соответственно, причем все результаты этих исследований были отрицательными (Таблица 1).
Таблица 1. Характеристики матерей и новорожденных по данным опубликованных исследований (только случаи, в которых проводилось обследование новорожденного на SARS-CoV-2). Если информации об исследовании некоторых образцов не было, считалось, что оно не выполнялось.
NP = Not Performed (не производилось) / NS = Not Stated (не указано).
a Только две пациентки обследованы.
b Исследована только плацента.
c У матери двойни были характерные клинические симптомы и вирусная интерстициальная пневмония по данным КТ органов грудной полости. Несмотря на то, что результат мазка из носоглотки был отрицательным, другие заболевания, способные вызвать лихорадку и поражение легких, были исключены. Местный ЦКЗ зарегистрировал данный случай как подтвержденный случай 2019-nCoV.
d Один из результатов оказался положительным через 3 дня после родов.
e Одна беременность двойней.
f Были исследованы образцы плаценты и пуповинной крови только у новорожденного с положительным результатом.
g Только для трех новорожденных с положительным результатом исследования.
h Только у 10 пациенток был лабораторно подтвержденный COVID-19. Согласно данным исследования, клинически диагностированный COVID-19 был определен как случай пневмонии, которая полностью соответствовала следующим 4 критериям: лихорадка и/или респираторные симптомы; рентгенологические свидетельства типичной вирусной пневмонии (двусторонний симптом «матового стекла»); низкий или нормальный уровень лейкоцитов или низкий уровень лимфоцитов; и отсутствие регресса симптомов после антибактериальной терапии в течение 2 дней, — при исключении распространенных вирусных инфекций, таких как грипп, без/с эпидемиологической связью с оптовым рынком морепродуктов Хуанань или с контактом с другими пациентами с аналогичными симптомами.
I Были взяты только 10 образцов грудного молока.
j Клинические характеристики и лабораторные данные описаны для 99 пациентов, но только 86 новорожденных были протестированы на SARS-CoV-2.
k Только 6 матерей были обследованы.
l Образцы грудного молока были исследованы только у 12 женщин.
m Были обследованы только 10 пациентов.
Среди 179 новорожденных, у шести SARS-CoV-2 был обнаружен в образцах из носоглотки: у одного в возрасте 16 часов жизни, у двух — 36 часов жизни, у трех — 48 часов жизни. Таким образом, в этих случаях время передачи инфекции не может быть точно установлено. Передача может происходить после родов воздушно-капельным путем от инфицированных родителей или медицинских работников, либо во время грудного вскармливания. Авторы утверждают, что эти дети были рождены путем кесарева сечения, немедленно разделены со своими матерями и помещены в отдельный кувез, что свидетельствует о малой вероятности постнатальной передачи от матери. На сегодняшний день данные об исследовании грудного молока представлены в 26 случаях, SARS-CoV-2 в образцах не обнаружен [17, 19, 33, 35, 36, 37]. Таким образом, трансплацентарная передача не может быть полностью исключена, и передача инфекции в описанных случаях также могла произойти в процессе прохождения через родовые пути [38].
Zeng et al. и Dong et al. описали три случая новорожденных с положительными анти-SARS-CoV-2 IgM и IgG по результатам серологического исследования, чьи матери были положительными на SARS-CoV-2 [32, 33]. Материнские IgG могут проникать через плаценту, но IgM вырабатываются плодом (новорожденным), что предполагает внутриутробную передачу вируса SARS-CoV-2 [39]. Тем не менее, является ли это доказательством внутриутробной передачи инфекции, остается спорным [40]. Чувствительность/специфичность метода определения IgM составила бы 88,2 %/96,2 % и 70,2 %/99 % в соответствии с теми же исследованиями и, таким образом, была бы намного выше, чем при других вирусных инфекциях. Кроме того, ни у одного из детей не было положительного результата ОТ-ПЦР ни в мазке из носоглотки [32, 33], ни в крови [32]. Кроме того, снижение уровня IgM в исследовании Dong L. происходило очень быстро: от 45,83 Ед/мл к 2 ч жизни до 11,75 Ед/мл на 14-й день жизни (при пороге определения 10 Ед/мл), что кажется неожиданным в случае внутриутробной инфекции.
Хотя у большинства детей, рожденных от инфицированных матерей, не было клинических симптомов, у троих из них была тяжелая пневмония, ассоциированная с SARS-CoV-2 [30]. У этих трех детей вероятность пери- или постнатальной передачи инфекции маловероятна, поскольку они родились путем операции кесарева сечения и были разделены с матерями с момента рождения. В перинатальном периоде инфекция SARS-CoV-2 у матери может иметь опасные последствия в отношении исходов и для новорожденных и приводить, в частности, к развитию респираторных расстройств, биологических нарушений, преждевременных родов и даже антенатальной гибели плода [41]. Авторы предполагают, что гипоксемия у матери может быть причиной гипоксии плода и преждевременных родов. Наконец, описано весьма мало случаев крайне тяжелого течения заболевания у очень маленьких детей [42], и это предполагает, что новорожденные могут быть маловосприимчивы к COVID-19.
До сих пор нет данных об инфекции SARS-CoV-2 у беременных в первом и втором триместрах, в том числе, о риске невынашивания беременности в ранние сроки, антенатальной гибели и задержке роста плода. По данным одного исследования, в околоплодных водах не было обнаружено вирусной РНК в середине беременности у двух пациенток, инфицированных в первом триместре [43]. В исследовании, опубликованном в 2004 году во время эпидемии ТОРС, сообщается о более высокой частоте самопроизвольных абортов, преждевременных родов и задержки роста плода, но свидетельств в пользу вертикальной передачи инфекции не было [44]. Кроме того, у беременных женщин, инфицированных SARS-CoV-2, не наблюдается аномально высокой смертности по сравнению с данными из опыта эпидемий SARS-CoV-1 и MERS-CoV [45]. До настоящего времени не было описано признаков фетопатии у плода или новорожденного, у матери которого был диагностирован COVID-19.
Заключение
Имеющиеся на сегодняшний день данные свидетельствуют о крайне редкой передаче инфекции от матери плоду, но информация, в основном, неполная. Согласно имеющимся данным, риск передачи инфекции от матери плоду очень низкий и составляет, вероятно, менее 1 %. Однако в тяжелых и критически тяжелых случаях течения заболевания на поздних сроках беременности вирус может обнаруживаться в плаценте. В случае внутриутробной передачи инфекции вирус и последствия поражения им обнаруживаются в синцитиотрофобласте, а также в околоплодных водах и крови плода [46]. Доступные на данный момент результаты исследований относятся к пациенткам, инфицированным на поздних сроках беременности, и следует акцентировать внимание на малом промежутке времени (несколько дней) между манифестацией инфекции у матери и родами, что может быть недостаточным для осуществления трансплацентарной передачи инфекции.
У нас недостаточно данных о естественном течении заболевания, связанного с SARS-CoV-2, у беременных женщин, а также о риске вертикальной передачи инфекции. Необходимы дальнейшие проспективные когортные исследования для прояснения следующих вопросов:
- Как SARS-CoV-2 воздействует на исходы беременности для матери и плода, и как данные исходы связаны со сроком беременности на момент инфицирования, со степенью тяжести течения заболевания и с интенсивностью предпринятого вмешательства, в том числе, с определенными вариантами лечения?
- Как соотносятся интенсивность репликации вируса и его персистенция в клетках носоглотки, кишечника и крови у беременных?
- Какова вероятность передачи инфекции от матери ребенку в течение беременности, родов и в послеродовом периоде при условии совместного пребывания матери и новорожденного?
- Также необходимы исследования in vitro или ex vivo для уточнения факта инфицирования клеток и возможности репликации вируса в децидуальной ткани и плаценте.
Ответы на перечисленные вопросы помогут в совершенствовании имеющихся рекомендаций [47] в отношении беременных с COVID-19 и их детей.
Список литературы
- Na Zhu, Dingyu Zhang, Wenling Wang, Xingwang Li, Bo Yang, Jingdong Song, Xiang Zhao, et al. A novel coronavirus from patients with pneumonia in China, 2019. N. Engl. J. Med., 382 (8) (2020), pp. 727-733, 10.1056/NEJMoa2001017
- Enders K.O. Ng, David S. Hui, K.C. Allen Chan, Emily C.W. Hung, Rossa W.K. Chiu, Alan Wu Nelson Lee, et al. Quantitative analysis and prognostic implication of SARS coronavirus RNA in the plasma and serum of patients with severe acute respiratory syndrome. Clin. Chem., 49 (12) (2003), pp. 1976-1980, 10.1373/clinchem.2003.024125
- Paul R. Grant, Jeremy A. Garson, Richard S. Tedder, Paul K.S. Chan, John S. Tam, Joseph J.Y. Sung. Detection of SARS coronavirus in plasma by real-time RT-PCR. N. Engl. J. Med., 349 (25) (2003), pp. 2468-2469, 10.1056/NEJM200312183492522
- James B. Mahony, Susan Richardson. Molecular diagnosis of severe acute respiratory syndrome. J. Mol. Diagn., 7 (5) (2005), pp. 551-559, 10.1016/S1525-1578(10)60587-9
- Wenling Wang, Yanli Xu, Ruqin Gao, Roujian Lu, Kai Han, Guizhen Wu, Tan Wenjie. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA (March) (2020), 10.1001/jama.2020.3786
- Chaolin Huang, Yeming Wang, Xingwang Li, Lili Ren, Jianping Zhao, Yi Hu, Li Zhang, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet (London, England), 395 (10223) (2020), pp. 497-506, 10.1016/S0140-6736(20)30183-5
- Roman Wölfel, Victor M. Corman, Wolfgang Guggemos, Michael Seilmaier, Sabine Zange, Marcel A. Müller, Daniela Niemeyer, et al. Virological assessment of hospitalized patients with COVID-2019. Nature (April) (2020), pp. 1-10, 10.1038/s41586-020-2196-x
- Jasper Fuk-Woo Chan, Cyril Chik-Yan Yip, Kelvin Kai-Wang To, Tommy Hing-Cheung Tang, Sally Cheuk-Ying Wong, Kit-Hang Leung, Agnes Yim-Fong Fung, et al. Improved molecular diagnosis of COVID-19 by the novel, highly sensitive and specific COVID-19-RdRp/Hel real-time reverse transcription-polymerase chain reaction assay validated in vitro and with clinical specimens. J. Clin. Microbiol. (March) (2020), 10.1128/JCM.00310-20
- Jerome Hadjadj, Nader Yatim, Laura Barnabei, Aurelien Corneau, Jeremy Boussier, Helene Pere, Bruno Charbit, et al. Impaired type I interferon activity and exacerbated inflammatory responses in severe Covid-19 patients. MedRxiv (April) (2020), 10.1101/2020.04.19.20068015
- Yong Xiong, Yuan Liu, Liu Cao, Dehe Wang, Ming Guo, Ao Jiang, Dong Guo, et al. Transcriptomic characteristics of bronchoalveolar lavage fluid and peripheral blood mononuclear cells in COVID-19 patients. Emerg. Microbes Infect., 9 (1) (2020), pp. 761-770, 10.1080/22221751.2020.1747363
- Xinling Wang, Wei Xu, Gaowei Hu, Shuai Xia, Zhiping Sun, Zezhong Liu, Youhua Xie, Rong Zhang, Shibo Jiang, Lu Lu. SARS-CoV-2 infects T lymphocytes through its spike protein-mediated membrane fusion. Cell. Mol. Immunol. (April) (2020), pp. 1-3, 10.1038/s41423-020-0424-9
- Xiaotong Wang, Zhiqiang Zhou, Jianping Zhang, Fengfeng Zhu, Yongyan Tang, Xinghua Shen. A case of 2019 novel coronavirus in a pregnant woman with preterm delivery. Clin. Infectious Diseases (February) (2020), 10.1093/cid/ciaa200
- Zhisheng Her, Benoit Malleret, Monica Chan, Edward K.S. Ong, Siew-Cheng Wong, Dyan J.C. Kwek, Hugues Tolou, et al. Active infection of human blood monocytes by chikungunya virus triggers an innate immune response. J. Immunol., 184 (10) (2010), pp. 5903-5913, 10.4049/jimmunol.0904181
- Concetta Castilletti, Licia Bordi, Eleonora Lalle, Gabriella Rozera, Fabrizio Poccia, Chiara Agrati, Isabella Abbate, Maria R. Capobianchi. Coordinate induction of IFN-α and -γ by SARS-CoV also in the absence of virus replication. Virology, 341 (1) (2005), pp. 163-169, 10.1016/j.virol.2005.07.015
- Sydney M. Nguyen, Kathleen M. Antony, Dawn M. Dudley, Sarah Kohn, Heather A. Simmons, Bryce Wolfe, M. Shahriar Salamat, et al. Highly efficient maternal-fetal zika virus transmission in pregnant rhesus macaques. PLoS Pathog., 13 (5) (2017), Article e1006378, 10.1371/journal.ppat.1006378
- S. Chen, B. Huang, D.J. Luo, X. Li, F. Yang, Y. Zhao, X. Nie, B.X. Huang. Pregnant women with new coronavirus infection: a clinical characteristics and placental pathological analysis of three cases. Zhonghua Bing Li Xue Za Zhi, 49 (0) (2020), p. E005, 10.3760/cma.j.cn112151-20200225-00138
- Weiyong Liu, Qianli Wang, Qi Zhang, Ling Chen, Junbo Chen, Bo Zhang, Yanjun Lu, et al. Coronavirus Disease 2019 (COVID-19) During Pregnancy: A Case Series. February (2020) preprints.org
- Nan Yu, Wei Li, Qingling Kang, Zhi Xiong, Shaoshuai Wang, Xingguang Lin, Yanyan Liu, et al. Clinical features and obstetric and neonatal outcomes of pregnant patients with COVID-19 in Wuhan, China: a retrospective, single-centre, descriptive study. Lancet Infect. Dis. (March) (2020), 10.1016/S1473-3099(20)30176-6
- Shaoshuai Wang, Lili Guo, Ling Chen, Weiyong Liu, Yong Cao, Jingyi Zhang, Ling Feng. A case report of neonatal COVID-19 infection in China. Clin. Infectious Diseases (March) (2020), 10.1093/cid/ciaa225
- Zheng. n.d. “Single-Cell RNA Expression Profiling of ACE2 and AXL in the Human Maternal–Fetal Interface.” Accessed April 6, 2020. repdevmed.org.
- Anat Levy, Yoram Yagil, Michael Bursztyn, Ronit Barkalifa, Shimon Scharf, Chana Yagil. ACE2 expression and activity are enhanced during pregnancy. Am. J. Physiol. Regul. Integr. Comp. Physiol., 295 (6) (2008), pp. R1953-1961, 10.1152/ajpregu.90592.2008
- C.A. Penfield, S.G. Brubaker, M.A. Limaye, J. Lighter, A.J. Ratner, K.M. Thomas, J. Meyer, A.S. Roman. Detection of SARS-COV-2 in placental and fetal membrane samples. Am. J. Obstetrics Gynecology MFM (2020), 10.1016/j.ajogmf.2020.100133 [перевод]
- G.N. Algarroba, P. Rekawek, S.A. Vahanian, P. Khullar, T. Palaia, M.R. Peltier, M.R. Chavez, A.M. Vintzileos. Visualization of SARS-CoV-2 virus invading the human placenta using electron microscopy. Am. J. Obstetrics Gynecology (2020), 10.1016/j.ajog.2020.05.023
- K.F. To, Joanna H.M. Tong, Paul K.S. Chan, Florence W.L. Au, Stephen S.C. Chim, K.C. Allen Chan, Jo L.K. Cheung, et al. Tissue and cellular tropism of the coronavirus associated with severe acute respiratory syndrome: an in-situ hybridization study of fatal cases. J. Pathol., 202 (2) (2004), pp. 157-163, 10.1002/path.1510
- Yongwen Chen, Zeqing Feng, Bo Diao, Rongshuai Wang, Gang Wang, Chenhui Wang, Yingjun Tan, et al. The novel severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) directly decimates human spleens and lymph nodes. medRxiv (March) (2020), 10.1101/2020.03.27.20045427
- Paul Chih-Hsueh Chen, Cheng-Hsiang Hsiao. Re: to KF, tong JH, chan PK, et al. Tissue and cellular tropism of the coronavirus associated with severe acute respiratory syndrome: an in-situ hybridization study of fatal cases. J pathol 2004; 202: 157-163. J. Pathol., 203 (2) (2004), pp. 729-730, 10.1002/path.1575 author reply 730-731
- S. Lagaye, M. Derrien, E. Menu, C. Coïto, E. Tresoldi, P. Mauclère, G. Scarlatti, et al. Cell-to-cell contact results in a selective translocation of maternal human immunodeficiency virus type 1 quasispecies across a trophoblastic barrier by both transcytosis and infection. J. Virol., 75 (10) (2001), pp. 4780-4791, 10.1128/JVI.75.10.4780-4791.2001
- Lin Qiu, Xia Liu, Meng Xiao, Jing Xie, Wei Cao, Zhengyin Liu, Abraham Morse, Yuhua Xie, Taisheng Li, Zhu Lan. SARS-CoV-2 is not detectable in the vaginal fluid of women with severe COVID-19 infection. Clin. Infectious Diseases (April) (2020), 10.1093/cid/ciaa375
- Huaping Zhu, Lin Wang, Chengzhi Fang, Sicong Peng, Lianhong Zhang, Guiping Chang, Shiwen Xia, Wenhao Zhou. Clinical analysis of 10 neonates born to mothers with 2019-NCoV pneumonia. Transl. Pediatr., 9 (1) (2020), pp. 51-60, 10.21037/tp.2020.02.06
- Lingkong Zeng, Shiwen Xia, Wenhao Yuan, Kai Yan, Feifan Xiao, Jianbo Shao, Wenhao Zhou. Neonatal early-onset infection with SARS-CoV-2 in 33 neonates born to mothers with COVID-19 in Wuhan, China. JAMA Pediatr. (March) (2020), 10.1001/jamapediatrics.2020.0878
- Noelle Breslin, Caitlin Baptiste, Cynthia Gyamfi-Bannerman, Russell Miller, Rebecca Martinez, Kyra Bernstein, Laurence Ring, et al. COVID-19 infection among asymptomatic and symptomatic pregnant women: two weeks of confirmed presentations to an affiliated pair of New York City Hospitals. Am. J. Obstetrics Gynecol. MFM (April) (2020), Article 100118, 10.1016/j.ajogmf.2020.100118
- Hui Zeng, Chen Xu, Junli Fan, Yueting Tang, Qiaoling Deng, Wei Zhang, Xinghua Long. Antibodies in infants born to mothers with COVID-19 pneumonia. JAMA (March) (2020), 10.1001/jama.2020.4861
- Lan Dong, Jinhua Tian, Songming He, Chuchao Zhu, Jian Wang, Chen Liu, Jing Yang. Possible vertical transmission of SARS-CoV-2 from an infected mother to her newborn. JAMA (March) (2020), 10.1001/jama.2020.4621
- Pu Yang, Xia Wang, Pin Liu, Cong Wei, Bingyan He, Junwen Zheng, Dongchi Zhao. Clinical characteristics and risk assessment of newborns born to mothers with COVID-19. J. Clin. Virol., 127 (April) (2020), Article 104356, 10.1016/j.jcv.2020.104356
- Wei Liu, Jing Wang, Wenbin Li, Zhaoxian Zhou, Siying Liu, Zhihui Rong. Clinical characteristics of 19 neonates born to mothers with COVID-19. Front. Med. (April) (2020), 10.1007/s11684-020-0772-y
- Maria Claudia Alzamora, Tania Paredes, David Caceres, Camille M. Webb, Luis M. Valdez, Mauricio La Rosa. Severe COVID-19 during pregnancy and possible vertical transmission. Am. J. Perinatol. (April) (2020), 10.1055/s-0040-1710050
- Jie Yan, Juan Juan. Guo, Cuifang Fan, Juan. Juan, Xuechen Yu, Jiafu Li, Ling Feng, et al. Coronavirus disease 2019 (COVID-19) in pregnant women: a report based on 116 cases. Am. J. Obstet. Gynecol. (April) (2020), 10.1016/j.ajog.2020.04.014
- Huijun Chen, Juanjuan Guo, Chen Wang, Fan Luo, Xuechen Yu, Wei Zhang, Jiafu Li, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet (London, England), 395 (10226) (2020), pp. 809-815, 10.1016/S0140-6736(20)30360-3
- A. Malek, R. Sager, P. Kuhn, K.H. Nicolaides, H. Schneider. Evolution of maternofetal transport of immunoglobulins during human pregnancy. Am. J. Reprod. Immunol. (New York), 36 (5) (1996), pp. 248-255, 10.1111/j.1600-0897.1996.tb00172.x
- David W. Kimberlin, Sergio Stagno. Can SARS-CoV-2 infection be acquired in utero?: More definitive evidence is needed. JAMA (March) (2020), 10.1001/jama.2020.4868
- Yangli Liu, Haihong Chen, Kejing Tang, Guo Yubiao. Clinical manifestations and outcome of SARS-CoV-2 infection during pregnancy. J. Infect. (March) (2020), 10.1016/j.jinf.2020.02.028
- Yuxia Cui, Maolu Tian, Dong Huang, Xike Wang, Yuying Huang, Li Fan, Liang Wang, et al. A 55-Day-Old female infant infected with COVID 19: presenting with pneumonia, liver injury, and heart damage. J. Infect. Dis. (March) (2020), 10.1093/infdis/jiaa113
- Nan Yu, Wei Li, Qingling Kang, Wanjiang Zeng, Ling Feng, Wu Jianli. No SARS-CoV-2 detected in amniotic fluid in mid-pregnancy. Lancet Infect. Dis. (April) (2020), 10.1016/S1473-3099(20)30320-0
- Shell F. Wong, Kam M. Chow, Tse N. Leung, Wai F. Ng, Tak K. Ng, Chi C. Shek, Pak C. Ng, et al. Pregnancy and perinatal outcomes of women with severe acute respiratory syndrome. Am. J. Obstet. Gynecol., 191 (1) (2004), pp. 292-297, 10.1016/j.ajog.2003.11.019
- David A. Schwartz. An analysis of 38 pregnant women with COVID-19, their newborn infants, and maternal-fetal transmission of SARS-CoV-2: maternal coronavirus infections and pregnancy outcomes. Arch. Pathol. Lab. Med. (March) (2020), 10.5858/arpa.2020-0901-SA
- Alexandre Vivanti, Chistelle Vauloup-Fellous, Sophie Prevot, Veronique Zupan, Cecile Suffee, Jeremy Do Cao, Alexandra Benachi, Daniele De Luca. Transplacental transmission of SARS-CoV-2 infection. Nat. Commun. (2020) Google Scholar
- V. Peyronnet, J. Sibiude, P. Deruelle, C. Huissoud, X. Lescure, J.-C. Lucet, L. Mandelbrot, et al. SARS-CoV-2 infection during pregnancy. Information and proposal of management care. CNGOF. Gynecol. Obstet. Fertil. Senol. (March) (2020), 10.1016/j.gofs.2020.03.014