Ведение пациентов с множественной миеломой во время пандемии COVID-19

Опубликовано: The Lancet 27.04.2020
Специальность: Инфекционные болезни, Гематология
Автор: Florent Malard, Mohamad Mohty
Перевод: Лагерь Ирина, Фонд профилактики рака
Новый коронавирус зоонозного происхождения появился в Китае в конце декабря 2019 года. Инфекция под названием коронавирусная болезнь 2019 (COVID-19) в настоящее время распространяется по всему миру. Вирус, вызывающий тяжелый острый респираторный синдром коронавирус-2 (SARS-CoV-2) представляет собой РНК-бета-коронавирус с оболочкой, имеющей филогенетическое сходство с другим известным коронавирусом, SARS-CoV-1, возбудителем атипичной пневмонии, ответственной за серьезную вспышку эпидемии в 2003 году. Контагиозный потенциал этого вируса характеризуется высокой скоростью распространения и непредсказуемостью течения. По состоянию на 20 апреля 2020 года было подтверждено более 2,4 миллиона случаев COVID-19, в результате которых во всем мире погибло более 150 000 человек. Смертность может достигать 15 % у пожилых пациентов и пациентов с сопутствующими заболеваниями [1]. Тяжесть COVID-19 подразделяется на четыре типа: легкая, средняя, тяжелая и критическая. Кроме того, по оценкам, примерно 18 % пациентов имеют бессимптомное течение SARS-CoV-2 [2]. В настоящее время в Европе не было одобрено ни одного варианта лечения, а вакцина не была пока создана. Избегание контактов путем соблюдения рекомендуемых гигиенических процедур, изоляции инфицированных людей и социального дистанцирования — единственные стратегии профилактики, рекомендованные ВОЗ.
Факторы риска развития тяжелого течения и смерти от COVID-19 включают в себя пожилой возраст и наличие сопутствующих заболеваний, таких как диабет, гипертония или сердечно-сосудистые заболевания [1]. Кроме того, данные из Китая свидетельствуют о том, что у пациентов с раком частота тяжелого течения значительно выше (включая госпитализацию в отделения интенсивной терапии, необходимость вспомогательной вентиляции легких и смерть) после заражения SARS-CoV-2 по сравнению с пациентами без рака (семь [39 %] из 18 больных раком против 124 [8 %] из 1572 пациентов без рака; р = 0.0003) [3]. В другом исследовании [4] сообщалось, что у пациентов с раком вероятность заражения SARS-CoV-2 в два раза выше, чем у пациентов без рака. Важно отметить, что это исследование предполагает, что госпитализация и повторные посещения больницы, характерные для ведения пациентов с раком, являются потенциальными факторами риска инфицирования SARS-CoV-2. Данные о пациентах с гематологическими злокачественными заболеваниями скудны. Тем не менее, мы можем ожидать, что характер инфекции SARS-CoV-2 будет аналогичен таковому у пациентов с солидным раком. Были опубликованы рекомендации по ведению пациентов с солидным раком и гематологическими злокачественными новообразованиями (например, от Высшего совета по здравоохранению Франции). Тем не менее, эти рекомендации являются общими, и более конкретные могут потребоваться для отдельных типов злокачественных новообразований, включая множественную миелому, поскольку у пациентов с этим заболеванием имеется тяжелый гуморальный и клеточный иммунодефицит [5]. Этот дефицит связан с нарушением реакции на опухоль, микробные и вакцинные антигены. Поэтому следует обратить внимание на эту группу высокого риска во время продолжающейся вспышки COVID-19. Здесь мы суммируем некоторые рекомендации, которые помогут справиться с пациентами с множественной миеломой во время пандемии COVID-19 (таблица).
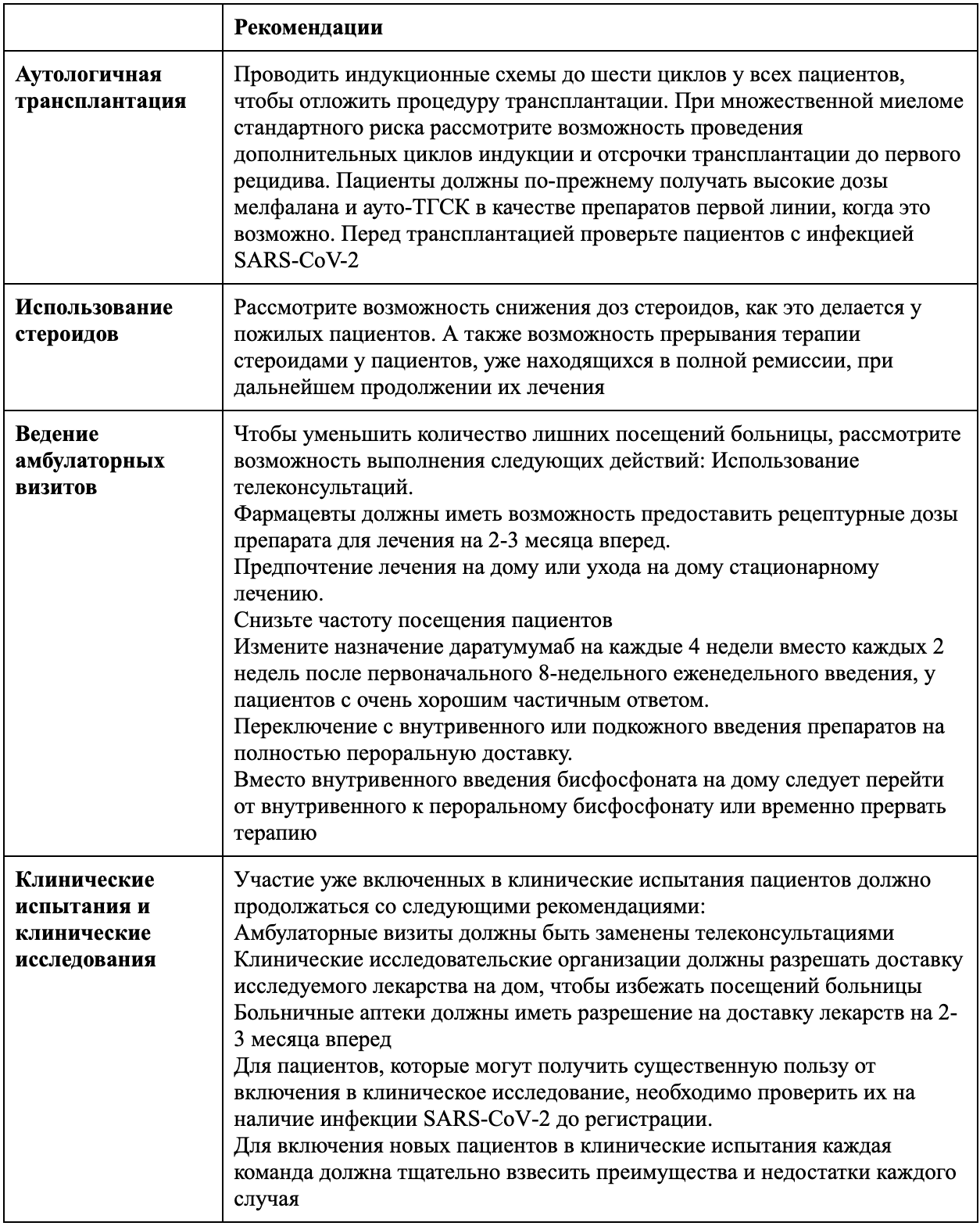
Рекомендации по ведению пациентов с множественной миеломой во время пандемии COVID-19
ауто-ТГСК= трансплантация аутологичных гемопоэтических стволовых клеток.
SARS-CoV-2 = тяжелый острый респираторный синдром коронавирус 2.
Высокая доза мелфалана и аутологичная трансплантация гемопоэтических клеток (ауто-ТГСК) остаются стандартом лечения для здоровых пациентов с недавно диагностированной множественной миеломой. Хотя восстановление гемопоэза после ауто-ТГСК происходит в течение 3 недель, полное восстановление функции T-клеток и B-клеток может занимать месяцы или годы, и ответы на вакцины в этот период, как правило, плохие. Кроме того, ожидается, что вспышка COVID-19 будет связана с нехваткой аппаратов искусственной вентиляции легких и коек для интенсивной терапии, в результате чего пациенты, получающие лечение от множественной миеломы, будут подвергаться повышенному риску, поскольку они могут также потребовать этих вмешательств. Другие жизненно важные процедуры для пациентов, которые принимали высокие дозы мелфалана и подвергались ауто-ТГСК, на которые может негативно повлиять COVID-19, включают доступность препаратов крови, поскольку количество доноров крови может уменьшиться в связи с рекомендацией самоизолироваться, что приведет к дефициту крови и препаратов тромбоцитов [6, 7]. Таким образом, решение о том, являются ли высокие дозы мелфалана и ауто-ТГСК подходящими для лечения пациентов с множественной миеломой, должно быть тщательно взвешено в текущих условиях пандемии COVID-19. Хотя общая практика заключается в использовании трех-четырех циклов индукционной химиотерапии перед ауто-ТГСК, было сообщено о применении шести циклов, что было связано с более глубокими реакциями, чем в стандартной практике [8]. Поэтому мы рекомендуем придерживаться режима индукции до шести циклов, а всем пациентам отложить лечение высокими дозами мелфалана и ауто-ТГСК. Кроме того, поскольку вспышка COVID-19 непредсказуема, необходимо учитывать дополнительные циклы индукции и откладывать трансплантацию до первого рецидива, при множественной миеломе стандартного риска. Данные, подтверждающие потенциальное отсутствие негативного исхода задержки ауто-ТГСК, получены из исследования IFM 2009 [9], в ходе которого пациенты получали три цикла бортезомиба, леналидомида и дексаметазона (схема RVD), а затем консолидационную терапию либо с пятью дополнительными циклами схемы RVD, либо с высоким доза мелфалан плюс ауто-ТГСК с последующими двумя дополнительными циклами RVD. Несмотря на то, что у пациентов в группе трансплантации перед началом лечения наблюдались лучшие результаты с точки зрения полной ремиссии, выживаемости без прогрессирования и измеримого остаточного заболевания, чем у пациентов в группе RVD, никакой разницы в общей выживаемости не наблюдалось, вероятно потому, что большинство пациентов получали высокие дозы мелфалана и ауто-ТГСК в качестве лечения второй линии в группе RVD. Следует отметить, что сбор стволовых клеток для криоконсервации во время первой линии лечения не является обязательным для каждого пациента, поскольку использование Плериксафора (Plerixafor) может предотвратить нарушение сбора, когда криоконсервация проводится во время второй линии лечения. Для пациентов с цитогенетикой высокого риска (особенно с выпадением хромосомы 17p) ситуация более сложная. Этим пациентам, возможно, потребуется принимать высокие дозы мелфалана и ауто-ТГСК в качестве препаратов первой линии. Тем не менее, учитывая, что примерно 18 % пациентов имеют бессимптомную инфекцию SARS-CoV-2, мы рекомендуем проверять пациентов на SARS-CoV-2 перед трансплантацией.
Пагубное влияние стероидов на исход лечения было установлено во время предыдущих вспышек коронавируса (SARS-CoV-1 и коронавирус-респираторного синдрома на Ближнем Востоке), и аналогичный эффект ожидается у пациентов, инфицированных SARS-CoV-2 [10]. Поэтому мы рекомендуем повторную оценку использования стероидов у каждого пациента с множественной миеломой. С одной стороны, обнадеживать пациентов и напоминать им, что стероиды являются основным препаратом против множественной миеломы и что им не следует прерывать лечение самостоятельно, очень важно. С другой стороны, врач должен рассмотреть возможность снижения доз стероидов, как это делается у пожилых пациентов, и даже прерывать прием стероидов у пациентов, уже находящихся в полной ремиссии, при непрерывном лечении.
Помимо пациентов, получающих высокие дозы мелфалана или ауто-ТГСК, большинство пациентов с множественной миеломой лечатся амбулаторно, с частыми визитами в больницу. Как указывалось ранее, госпитализация и повторные посещения, необходимые для ведения пациентов с раком, могут повысить риск инфицирования этих пациентов SARS-CoV-2 [4]. Следовательно, врачи должны быть особенно бдительны, чтобы уменьшить ненужные посещения больницы. Телеконсультация всегда должна поощряться, когда это возможно, особенно для пациентов, которые не проходят лечение или получают только пероральное лечение. Кроме того, фармацевты должны иметь возможность выдавать назначаемые дозы на срок лечения 2-3 месяцев лечения вместо обычного 1 месяца.
Для пациентов, которым требуются внутривенные или подкожные препараты, следует предпринять усилия, чтобы свести к минимуму посещения больниц, в зависимости от ситуации каждого пациента. Этой минимизации можно достичь, выполнив следующие действия: используя, по возможности, госпитализацию на дому или уход на дому, учитывая, что услуги по госпитализации на дому также могут быть перегружены во время вспышки COVID-19; изменение графика введения лечения на режим со сниженной частотой (например, переключение пациентов, получающих два раза в неделю карфилзомиб, на режим раз в неделю); учитывая фармакокинетику даратумумаба, после 8-недельного еженедельного введения 16 мг/кг, необходимого для быстрого насыщения клиренса, опосредованного мишенью, последующее расписание можно было изменить на дозу каждые 4 недели вместо каждых 2 недель (у пациентов с очень хорошим частичным ответом); и рассмотреть возможность перехода от внутривенного или подкожного лечения к полностью пероральной комбинации (например, бортезомиб можно заменить пероральным ингибитором протеасомы иксазомибом). Что касается бисфосфоната, в частности, внутривенное домашнее введение, переключение с внутривенного на пероральный бисфосфонат или временное прерывание — все это допустимые варианты.
Для пациентов, включенных в клинические испытания, их участие должно, в принципе, продолжаться. Тем не менее, безопасность пациентов должна оставаться приоритетом, и, как и в случае пациентов, проходящих лечение вне клинических испытаний, амбулаторные визиты должны быть заменены телеконсультацией, когда это возможно. Кроме того, для пациентов, получающих пероральное лечение в рамках клинического испытания, большинство организаций, занимающихся клиническими исследованиями, могут организовать доставку исследуемого лекарства на дом, чтобы избежать посещений больницы. В качестве альтернативы, больничные аптеки должны быть уполномочены на доставку лекарств на 2-3 месяца вместо стандартных 1 месяца.
При рассмотрении вопроса о включении новых пациентов в клинические испытания следует отметить, что большинство клинических испытаний приостановлено на время пандемии COVID-19. Кроме того, каждая команда должна тщательно взвесить преимущества и риски каждого нового включения. Для некоторых пациентов (например, тех, кто не поддается стандартному лечению или рецидивировал после лечения), клинические испытания позволяют получить доступ к лекарствам или комбинациям не по назначению, которые могут быть очень полезными, но в противном случае недоступны. Следовательно, приостановка всех включений в клинические испытания приведет к упущенным терапевтическим возможностям для значительного числа пациентов. Наконец, мы рекомендуем проверять пациентов на наличие инфекции SARS-CoV-2 перед любым включением в клиническое исследование.
В целом, лечение пациентов с множественной миеломой, вероятно, будет проблематичным во время текущей пандемии COVID-19. Хотя гематологические отделения должны последовательно использовать аналогичные рекомендации для ведения пациентов, некоторые решения должны приниматься на индивидуальной основе, в зависимости от характеристик заболевания и истории болезни пациента. Принятие решений не должно приводить к тому, что пациенты с множественной миеломой не получают наиболее эффективное лечение, поскольку рецидив или прогрессирование заболевания ставит этих пациентов под угрозу смерти.
Florent Malard сообщает о личных сборах от Therakos / Mallinckrodt, Janssen, Keocyte, Sanofi, JAZZ Pharmaceutical, Astellas и Biocodex вне представленной работы.
Mohamad Mohty сообщает о грантах и личных сборах от Janssen, Sanofi и JAZZ фармацевтический; личные взносы от Celgene, Amgen, Bristol-Myers Squibb и Takeda; и гранты от Роше за пределами представленной работы. Оба автора внесли одинаковый вклад в концепцию, написание, критический обзор и окончательное утверждение рукописи.
* Флоран Малард, Мохамад Мохти
florent.malard@inserm.fr
Клиника гематологической службы и клеточной терапии, Hôpital Saint-Antoine,
Университет Сорбонны, INSERM UMRs 938, Париж, 75012, Франция
Ссылки
- Onder G, Rezza G, Brusaferro S. Case-fatality rate and characteristics of patients dying in relation to COVID-19 in Italy. JAMA 2020; published online March 23. DOI:10.1001/jama.2020.4683.
- Mizumoto K, Kagaya K, Zarebski A, Chowell G. Estimating the asymptomatic proportion of coronavirus disease 2019 (COVID-19) cases on board the Diamond Princess cruise ship, Yokohama, Japan, 2020. Euro Surveill 2020; 25: pii=2000180.
- Liang W, Guan W, Chen R, et al. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol 2020; 21: 335–37.
- Yu J, Ouyang W, Chua MLK, Xie C. SARS-CoV-2 transmission in patients with cancer at a tertiary care hospital in Wuhan, China. JAMA Oncol 2020; published online March 25. DOI:10.1001/jamaoncol.2020.0980.
- Pratt G, Goodyear O, Moss P. Immunodeficiency and immunotherapy in multiple myeloma. Br J Haematol 2007; 138: 563–79.
- Ranney ML, Griffeth V, Jha AK. Critical supply shortages—the need for ventilators and personal protective equipment during the Covid-19 pandemic. N Engl J Med 2020; published online March 25. DOI:10.1056/ NEJMp2006141.
- Pagano MB, Hess JR, Tsang HC, et al. Prepare to adapt: blood supply and transfusion support during the first 2 weeks of the 2019 Novel Coronavirus (COVID-19) pandemic affecting Washington State. Transfusion 2020; published online March 21. DOI:10.1111/trf.15789.
- Rosiñol L, Oriol A, Rios R, et al. Bortezomib, lenalidomide, and dexamethasone as induction therapy prior to autologous transplant in multiple myeloma. Blood 2019; 134: 1337–45.
- Attal M, Lauwers-Cances V, Hulin C, et al. Lenalidomide, bortezomib, and dexamethasone with transplantation for myeloma. N Engl J Med 2017; 376: 1311–20.
- Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet 2020; 395: 473–75.