Вакцины против SARS-CoV-2: отчет о ходе работы

Оригинал: Медач
Автор: Fatima Amanat, Florian Krammer
Опубликовано: CellPress 14.04.20
Перевод: Дмитрий Кремлёв
Редакция: Анастасия Нагорняк
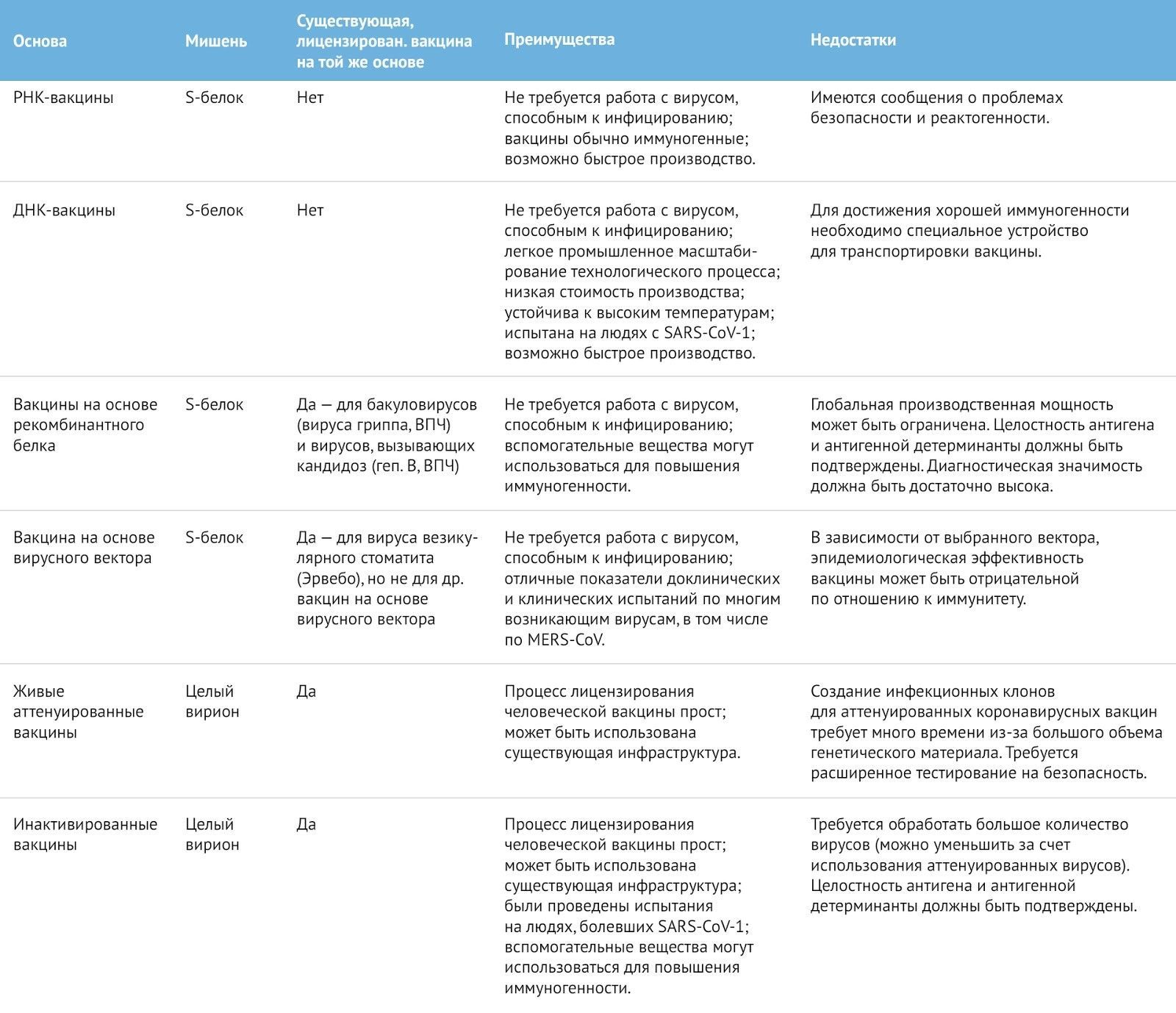
В настоящее время не существует вакцин от коронавируса. Кроме того, многие используемые технологии (методы производства, векторы и т.д.) являются новыми и требуют тщательной проверки на безопасность. Была определена мишень для вакцины — S-белок, и в настоящее время идет подбор соответствующих вакцин. Как правило, за этим следуют два важных шага, которые обычно необходимо провести до того, как вакцина будет подвергнута клиническим испытаниям.
Во-первых, вакцина тестируется на животных, чтобы убедиться, что она является работоспособной. Тем не менее, подобрать животных для испытания в отношении SARS-CoV-2 может быть проблематично. Вирус не растет у диких мышей и вызывает только легкую форму заболевания у трансгенных животных, экспрессирующих человеческий ангиотензинпревращающий фермент-2 (АПФ-2). К другим потенциальным животным для испытаний относятся хорьки и приматы, в отношении которых проводятся исследования патогенности. Даже при отсутствии животных,болеющих так же, как человек, можно оценить работает ли вакцина, поскольку сыворотка вакцинированных животных может быть протестирована в ходе анализов на нейтрализацию in vitro. В этих случаях также необходимо собирать данные о безопасности после вакцинации на предмет наличия осложнений, таких как те, которые были обнаружены при вакцинации против атипичной пневмонии (SARS-CoV-1) и вируса MERS-CoV.
Во-вторых, вакцины должны быть протестированы на токсичность у животных, например, у кроликов. Обычно оценка вирусной нагрузки не является частью этого процесса, поскольку оценивается только безопасность вакцины. Это тестирование, которое должно проводиться в соответствии с Надлежащей лабораторной практикой (GLP), как правило, занимает около 3-6 месяцев. Для некоторых типов вакцин часть испытаний на безопасность может быть пропущена, если уже имеются достаточные данные по аналогичным вакцинам, изготовленным по тому же технологическому процессу. Вакцины, предназначенные для использования на человеке, производятся в рамках, соответствующих действующей Надлежащей производственной практике (cGMP), чтобы обеспечить постоянное качество и безопасность использования вакцин. Для этого требуются специальные помещения, обученный персонал, надлежащая документация и сырье, которое было произведено с целью обеспечения качества cGMP.
Все эти процессы должны быть разработаны или изменены, чтобы соответствовать вакцинам против SARS-CoV-2. Для многих потенциальных вакцин, находящихся на доклинической стадии, такие процессы еще не разработаны, и все придется начинать с нуля. Как только будут получены достаточные доклинические данные и изготовлены первые партии вакцин, отвечающие качеству cGMP, могут быть начаты клинические испытания. Как правило, клиническая разработка вакцин начинается с небольших испытаний I фазы для оценки безопасности потенциальных вакцин у человека. За ними следует фаза II (разработка рецептуры и дозировки для первоначального доказательства эффективности) и, наконец, фаза III, в ходе которой эффективность и безопасность вакцины должны быть продемонстрированы в когорте с большой выборкой. Однако в такой чрезвычайной ситуации, как нынешняя, эта схема может быть сжата, и может быть разработана ускоренная схема нормативного утверждения. Если эффективность будет доказана, вакцина может быть лицензирована регулирующими органами.
Другим важным моментом является то, что есть необходимость в производственных мощностях для производства достаточного количества вакцины соответствующего качества. Для вакцин, основанных уже на существующих, например, инактивированных или живых ослабленных вакцинах, этого добиться достаточно легко, поскольку может быть использована существующая инфраструктура (табл. 1). Для вакцин, основанных на новых технологиях, например, мРНК, производственные мощности необходимо создавать с нуля, и это, как правило, занимает время. Это замечательно, если будет доступно даже ограниченное число доз вакцины для защиты медицинских работников и наиболее уязвимых слоев населения, но конечная цель все же должна заключаться в том, чтобы сделать вакцины доступными для всего населения планеты. Это будет непросто. Даже для вакцин против вируса гриппа, для которых существует много производственных мощностей в странах с высоким уровнем доходов, а также в странах с низким и средним уровнем доходов, спрос на них в случае пандемии значительно превысил бы производственные мощности.
Таблица 1 | Обзор методов и технологий производства вакцин от SARS-CoV-2
Наконец, требуется время для распространения вакцин и введения их в действие. Для вакцинации значительной части населения, вероятно, потребуются недели. Учитывая, что в настоящее время население наивно относится к SARS-CoV2, весьма вероятно, что потребуется более одной дозы вакцины.
В таких случаях обычно используются режимы первичной вакцинации, а вторая прививка ставится с интервалом в 3–4 недели. Вполне вероятно, что защитный иммунитет будет выработан только через 1–2 недели после второй вакцинации. Таким образом, к этому сроку добавляется еще 1–2 месяца. Даже если будут найдены короткие пути для прохождения нескольких этапов, упомянутых выше, маловероятно, что вакцина будет доступна раньше, чем через 6 месяцев после начала клинических испытаний. Реалистичным будет предположить, что вакцины против SARS-CoV-2 не будут доступны еще в течение 12–18 месяцев.
Каковы возможные решения для сокращения этих длительных сроков в будущем? Одна из возможностей заключается в создании производственных мощностей, которые, по возможности, будут повсеместны, и которые могут быть задействованы в случае появления новых вирусов. С сегодняшней точки зрения, только несколько видов вирусов могут вызвать респираторные заболевания, которые приведут к быстрому глобальному распространению. Наблюдение за животными в сочетании с исследованиями характеристик вирусов может выявить иные вирусы, которые могут вызывать пандемии. Потенциальные вакцины, использующие эти изоляты, затем могут быть произведены, протестированы на животных для определения механизмов защиты и протестированы на людях для установления безопасности вакцин. Маловероятно, что те же самые вирусы, которые были выбраны в качестве потенциальных, впоследствии вызовут вспышки. Однако, если потенциальная вакцина достаточно близка к уже используемым, то вакцины для новых вирусов могут быть разработаны гораздо быстрее и сразу же переведены в более поздние фазы клинических испытаний (в то время как крупномасштабное производство наращивается во всем мире).
Кроме того, можно было бы производить вакцины на основе уже имеющихся даже в том случае, если они не совсем соответствуют штамму, вызывающему вспышку (стратегия, которая в настоящее время используется для вакцин против вирусов птичьего гриппа H5 и H7). Это позволило бы обеспечить ответные меры в течение нескольких недель и потенциально могло бы остановить распространение вируса до того, как он приведет к пандемии. Альтернативным, но сложным решением была бы разработка широко защитных вакцин, охватывающих целые семейства вирусов или родов. Эта работа продолжается в отношении вирусов гриппа и потенциально может быть применена к коронавирусам или, по крайней мере, к бетакоронавирусам. Оба эти варианта являются дорогостоящими и требуют глобального политического действия и дальновидности.
Клинические испытания с применением нуклеотидного аналога ремдесивира и ингибиторов протеазы, а также других вариантов лечения, проводятся в Китае и США. Получить результаты испытаний планируется в течение нескольких недель. Испытания на животных, в том числе и на приматах, показали активность ремдесивира в отношении коронавирусов, ассоциированных с атипичной пневмонией (SARS-CoV-2),а также в отношении MERS-CoV. Ремдесивир также тестировался для лечения Эболы у человека (и был признан менее успешным, чем другие методы лечения, согласно Mulangu и др., 2019), поэтому уже существуют данные касательно безопасности этого терапевтического средства, что должно ускорить процесс клинических испытаний в отношении SARS-CoV-2. Механизм действия ремдесивира как нуклеотидного аналога не до конца ясен, но он, скорее всего, предотвращает синтез РНК, приводит к инкорпорационному мутагенезу или и то, и другое.
Кроме того, комбинация двух лицензированных ВИЧ-ингибиторов — лопинавира и ритонавира — также участвует в клинических исследованиях. Лопинавир является истинным ингибитором протеазы, в то время как ритонавир изначально задумывался как ингибитор протеазы, но, как выяснилось позже, он увеличивает период полураспада лопинавира путем ингибирования цитохрома Р450. Эта комбинация использовалась для лечения SARS-CoV-1 в 2003–2004 гг. и показала обнадеживающие результаты. Эффективность данной комбинации была недостаточной у мышей, но хорошо заметна в испытаниях на приматах, зараженных MERS-CoV. Механизм действия лопинавира ясен не до конца, но он, вероятно, ингибирует одну или несколько коронавирусных протеаз.
Другие варианты лечения в текущих или планируемых клинических испытаниях включают введение дозы рекомбинантного человеческого АПФ-2 для нейтрализации вируса и предотвращения повреждения легких, а также использование противовирусного препарата арбидол, ингибитора слияния. Другим интересным вариантом является использование в качестве лечения сыворотки реконвалесцента, — клинические испытания данного метода проводятся в Китае и США. Аналогичным образом можно было бы использовать поликлональный человеческий иммуноглобулин G (IgG), полученный от трансгенных коров, потому что данная методика была успешно использована в отношении MERS-CoV в испытаниях на животных, и была доказана ее эффективность в клинических испытаниях. Многие из этих испытаний покажут результаты в течение нескольких месяцев, и если ремдесивир, лопинавир или ритонавир покажут свою эффективность, они потенциально могут быть широко использованы в ближайшее время. Уже имеются данные об использовании данных препаратов при лечении инфекции, вызванной SARS-CoV-2.
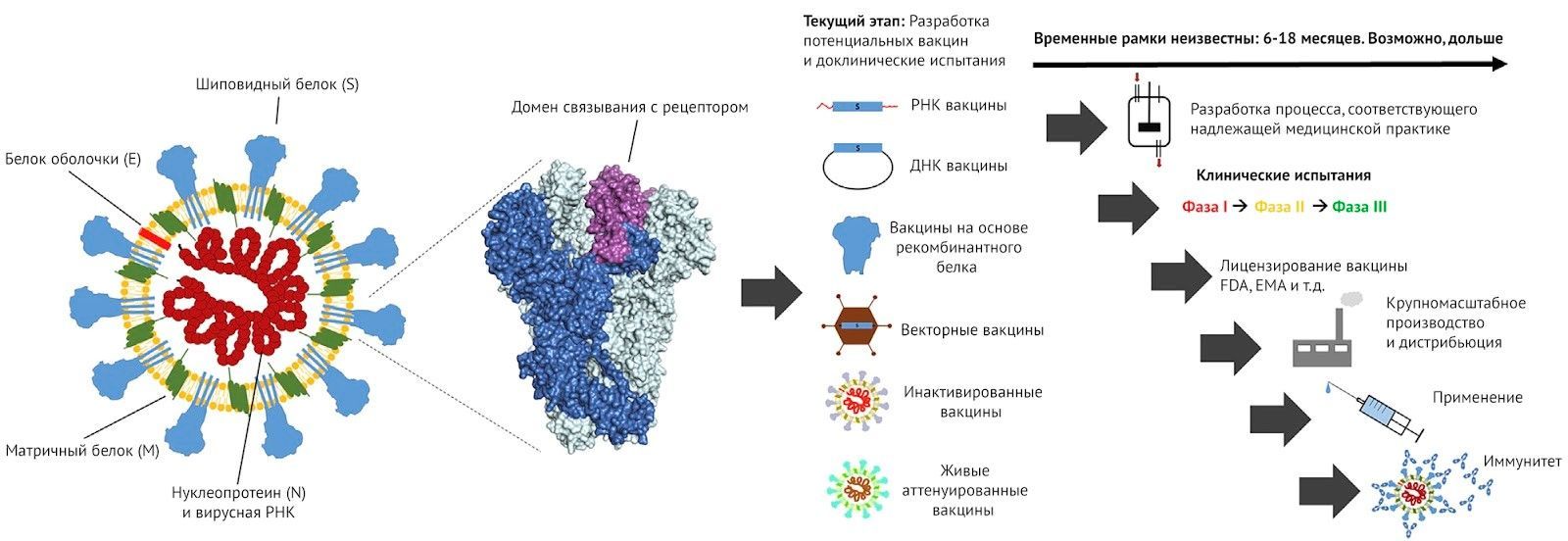
Разработка вакцин для человека может занять годы, особенно когда используются новые технологии, которые не были тщательно протестированы на безопасность и не развиты до серийного производства. Из-за того, что коронавирусных вакцин на рынке нет, соответственно и нет потенциала для их крупномасштабного производства (табл. 1), поэтому мы должны будем создавать это все с нуля. Делать подобное достаточно трудоемко и может занять много времени (рис. 1). Коалиция по инновациям в сфере готовности эпидемиям (The Coalition for Epidemic Preparedness Innovation (CEPI)) выделила средства нескольким новаторским игрокам на этом рынке, и многие из них, скорее всего, в конечном итоге преуспеют в создании вакцины против SARS-CoV-2.
Рисунок 1 | Обзор потенциальных вакцин в отношении SARS-CoV-2
Слева схематично изображена структура коронавируса с указанием различных вирусных белков. S-протеин (или S-белок) является основной мишенью для разработки вакцины.
Показанная структура шипов основана на тримерном шипе SARS-CoV-1. Один тример показан темно-синим цветом, а рецепторный связывающий домен, являющийся главной мишенью нейтрализующих антител, выделен фиолетовым цветом. Два других тримера показаны светло-голубым цветом. Потенциальные вакцины от атипичной пневмонии (SARS-CoV-2) на основе различных разработок уже перешли к стадии доклинических испытаний. Для одной из вакцин на основе мРНК уже началось клиническое испытание и недавно был запущен набор добровольцев. Однако прежде, чем эти вакцины будут применены на населении, пройдут еще месяцы и даже годы. Для некоторых вакцин уже разработаны технологические процессы, соответствующие cGMP.
Методология клинических испытаний может быть изменена, чтобы сократить данный период.
Однако ни одна из этих компаний и институтов не имеют адаптированного портфеля разрабатываемых препаратов, таких как вакцины на поздней стадии клинических испытаний, позволивших бы осуществить их лицензирование контролирующими органами, а также не имеют возможностей для производства необходимого количества препаратов. Вакцина на основе мРНК, которая экспрессировала бы целевой антиген in vivo после инъекции мРНК, инкапсулированной в липидные наночастицы, разрабатывается совместно компаниями «Moderna» и «Vaccine Research Center» в Национальном Институте Здравоохранения и в настоящее время продвинулись дальше всех и уже перешли к первому этапу клинических испытаний. «Curevac» работает над похожей вакциной, однако она все еще находится в доклинической фазе. На доклиническом этапе также находятся рекомбинантно-белковые вакцины, вирусные вакцины, ДНК вакцины, вакцины на основе живых ослабленных вирусов, а также инактивированные вирусные вакцины (рис. 1; табл. 1).
Все эти подходы имеют свои преимущества и недостатки (табл. 1), и невозможно предсказать, какая из них будет быстрее доведена до ума и окажется успешнее. «Johnson & Johnson (J&J)», и «Sanofi» недавно объединили усилия по разработке вакцин против атипичной пневмонии SARS-CoV-2. Однако «J&J» использует экспериментальную вирусную вакцину, которая еще не лицензирована. Вакцина «Sanofi» будет создана с использованием технологии, похожей на ту, что применяется при создании лицензированной вакцины «Flublok» — рекомбинантной вакцины против вируса гриппа, однако до стадии, когда ее можно будет использовать для вакцинации населения, могут пройти еще месяцы, если не годы.