Триада COVID-19: иммунитет, воспаление и врачебное вмешательство

Оригинал: nature.com
Тип: статья
Специальность: Инфекционные болезни; Лечение COVID-19
Автор: Matthew Zirui Tay et al
Опубликовано: 28.04.2020 (www.nature.com)
Перевод: Яна Белышева, Фонд профилактики рака
Аннотация
Коронавирус тяжелого острого респираторного синдрома - 2 (SARS-CoV-2) – это причинный агент продолжающейся коронавирусной пандемии 2019 (COVID-19). Наряду с исследованиями в области вирусологии SARS-CoV-2, понимание фундаментальных физиологических и иммунологических процессов, лежащих в основе клинических проявлений COVID-19, крайне необходимо для идентификации и рационального выбора эффективной терапии. В данной статье мы даем обзор патофизиологии инфекции SARS-CoV-2. Здесь мы описываем взаимодействие SARS-CoV-2 с иммунной системой, а также последующую роль дисфункциональной иммунной реакции на прогрессирование заболевания. Из появляющихся докладов, описывающих SARS-CoV-2, мы делаем предположения на базе параллельных патофизиологических и иммунологических особенностей других коронавирусных инфекций, поражающих нижние дыхательные пути – SARS-Cov-2 и MERS-CoV (коронавирус ближневосточного респираторного синдрома). В заключение, мы освещаем роль этих подходов для потенциальных терапевтических вмешательств, которое действует на вирусную инфекцию и/или иммунорегуляцию.
Патогенез COVID-19
Коронавирусы, как известно, вызывают заболевания у людей и животных. Среди них четыре (человеческие коронавирусы 229Е, NL63, OC43 и HKU1) обычно инфицируют только верхние дыхательные пути и вызывают относительно незначительные симптомы [1]. Однако есть три коронавируса (коронавирус тяжелого острого респираторного синдрома (SARS-CoV), коронавирус ближневосточного респираторного синдрома (MERS-CoV) и SARS-CoV-2), которые могут реплицироваться в нижних дыхательных путях и вызывать пневмонию, которая может быть смертельной. SARS-CoV-2 относится к роду Betacoronavirus. Ближайшим родственником среди человеческих коронавирусов является SARS-CoV с 79% генетического сходства [2]. Однако, среди всех известных коронавирусных последовательностей, SARS-CoV-2 наиболее похож на коронавирус летучей мыши RaTG13 с 98% сходства 3, и коронавирусная последовательность у панголина (чешуйчатого муравьеда) также имеет высокое сходство [4].
Как и другие респираторные коронавирусы, SARS-CoV-2 передается преимущественно воздушно-капельным путем с возможным, но не доказанным фекально-оральным путем передачи. Средний инкубационный период длится примерно 4-5 дней перед манифестацией заболевания [5-8], причем у 97,5% пациентов с симптомами они развиваются в течение 11,5 дней [8]. В момент поступления в больницу пациенты с COVID-19 обычно имеют такие симптомы, как лихорадка и сухой кашель; реже пациенты испытывают затруднённое дыхание, мышечную и/или суставную боль, головную боль/головокружение, диарею, тошноту и кровохарканье [5,9-14]. Через 5-6 дней после появления симптомов вирусная нагрузка SARS-CoV-2 достигает своего пика: значительно раньше, чем у родственного SARS-CoV, где вирусная нагрузка наибольшая примерно через 10 дней после появления симптомов [15-18]. Тяжелые случаи COVID-19 прогрессируют до острого респираторного дистресс-синдрома (ОРДС) в среднем за 8-9 дней после манифестации симптомов [10,19].
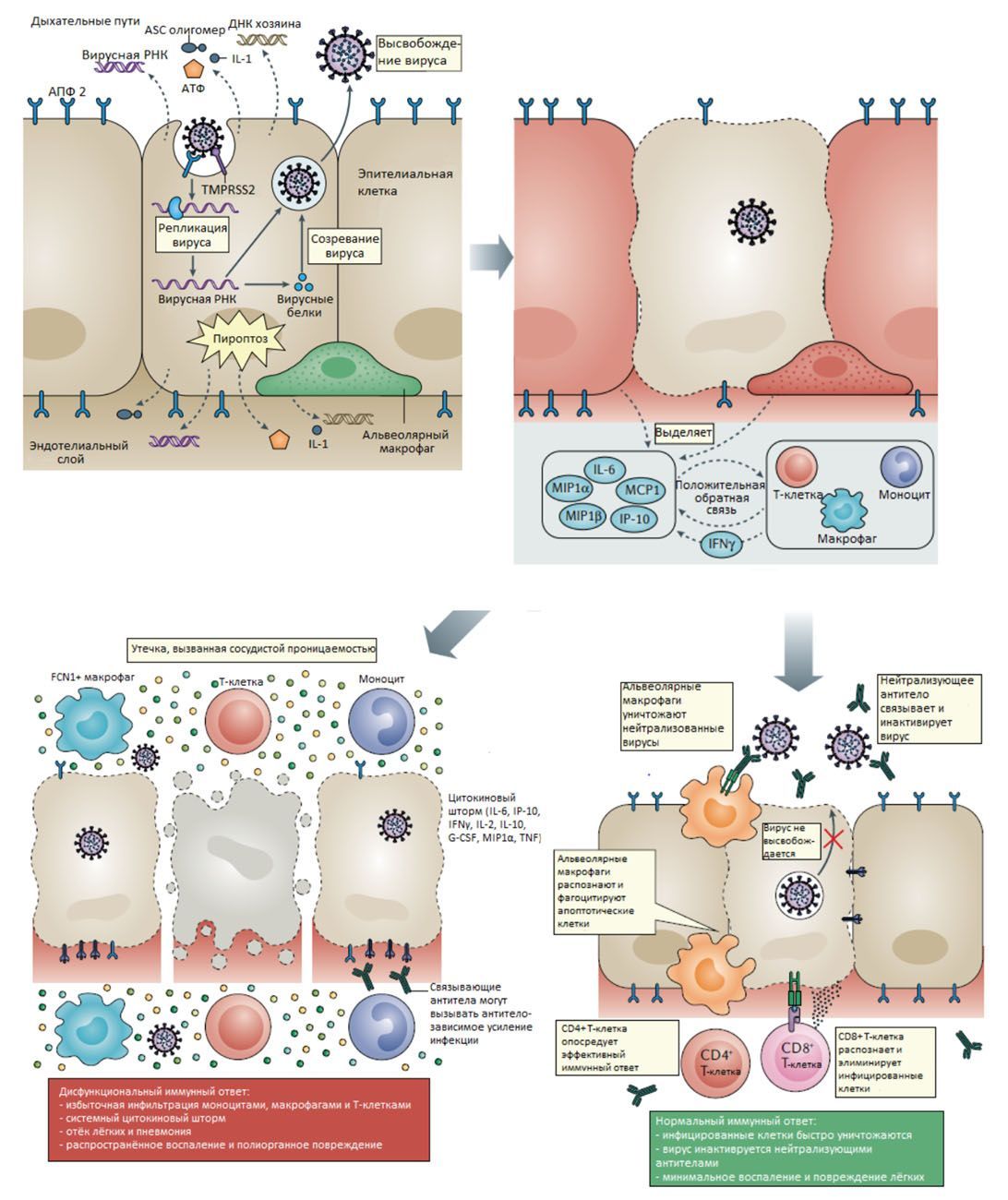
Рис.1. Хронология событий во время инфицирования SARS-CoV-2. Когда вирус тяжелого острого респираторного синдрома - 2 (SARS-CoV-2) инфицирует клетки, экспрессирующие на своей поверхности рецепторы ангиотензинпревращающего фермента 2 (АПФ 2) и TMPRSS2, активная репликация и высвобождение вируса приводят к пироптозу клеток хозяина и высвобождению молекулярных паттернов, связанных с повреждением (DAMPs), включая АТФ, нуклеиновые кислоты и ASC олигомеры. Они опознаются соседними эпителиальными клетками, эндотелиальными клетками и альвеолярными макрофагами, запуская выработку провоспалительных цитокинов и хемокинов (включая IL-6, IP-10, макрофагальный воспалительный белок 1α (MIP 1α), MIP1β и MCP1). Эти белки привлекают моноциты, макрофаги и T-клетки к месту инфекции, что создает условия для дальнейшего воспаления (с IFNγ, продуцируемым Т-клетками) и устанавливает провоспалительную цепь обратной связи. При дефектном иммунном ответе (левая сторона) это может привести к дальнейшей аккумуляции иммунных клеток в лёгких, вызывая гиперпродукцию провоспалительных цитокинов, которые в конце концов повреждают лёгочную инфраструктуру. Возникающий цитокиновый шторм достигает другие органы, приводя к полиорганной недостаточности. Вдобавок связывающие антитела, продуцируемые B-клетками, могут усиливать SARS-CoV-2 инфекцию через феномен антителозависимого усиления инфекции(АЗУИ), ещё более усугубляющий повреждение органа. С другой стороны, при нормальном иммунном ответе (правая сторона) изначальное воспаление привлекает вирус-специфичные Т-клетки к месту инфекции, где они могут уничтожить инфицированные клетки перед тем, как вирус распространится. Нейтрализующие антитела в таком организме могут блокировать вирусную инфекцию, а альвеолярные макрофаги узнать нейтрализованные вирусы и апоптотические клетки и устранить их путём фагоцитоза. Всё вместе эти процессы ведут к устранению вируса и минимальному повреждению лёгких, и в результате к выздоровлению.G-CSF, гранулоцитарный колониестимулирующий фактор; TNF– фактор некроза опухоли.
Патофизиологические механизмы при SARS-CoV-2 и SARS-CoV инфекциях очень похожи: агрессивный иммунный ответ, приводящий к повреждению дыхательных путей [20]. По этой причине тяжесть заболевания пациента связана не только с вирусной инфекцией, но также с ответом организма. Модель увеличивающейся тяжести с возрастом пациентов также широко согласуется с эпидемиологией SARS-CoV и MERS-CoV [5,10,13].
Острый респираторный дистресс-синдром, наблюдаемый при тяжелых случаях COVID-19, характеризуется затруднённым дыханием и низким содержанием кислорода в крови. Как результат, некоторые пациенты страдают от вторичной бактериальной или грибковой инфекции [13]. ОРДС может привести напрямую к дыхательной недостаточности, что является причиной смерти в 70% фатальных случаев при COVID-19 [21]. Вдобавок, масштабное выделение цитокинов иммунной системой в ответ на вирусную инфекцию и/или вторичные инфекции может привести к цитокиновому штормуи симптомам сепсиса, которые являются причиной смерти в 28% случаев фатальных случаев при COVID-19 [21]. В этих случаях неконтролируемое воспаление наносит полиорганное повреждение, приводящее к недостаточности органов, особенно сердечной, печёночной и почечной систем (рис.1). Большинство пациентов с SARS-CoVинфекцией, у которых развивается почечная недостаточность, в конечном счёте, умирают [22].
Инфицирование клеток хозяина и профилактические меры
Первый шаг инфекционного процесса – это прикрепление к клетке хозяина при помощи рецептора-мишени. Более ранняя работа по SARS-CoV показала, что этот вирус преимущественно нацелен на эпителиальные клетки дыхательных путей, альвеолярные эпителиальные клетки, сосудистые эпителиальные клетки, альвеолярные макрофаги, все из них экспрессируют ангиотензинпревращающий фермент 2 (АПФ 2) – рецептор-мишень хозяина, используемый SARS-CoV [23-25]. Так как SARS-CoV-2 использует этот же входной рецептор, разновидности этих клеток наверняка являются мишенями этого вируса [3,26.27]. Инфицирование SARS-CoV сокращает экспрессию АПФ 2 клетками лёгких. Так как потеря функции лёгочного АПФ ассоциирована с острым лёгочным повреждением, вирус-индуцированное снижение количества АПФ 2 может иметь значение для патогенеза заболевания [28-31]. Было показано, что АПФ 2 регулирует ренин-ангиотензиновую систему (РАС) [31]. Таким образом, сокращение функции АПФ 2 после вирусной инфекции может привести к дисфункции РАС, что влияет на артериальное давление и водно-электролитный баланс, а также увеличивает воспаление и сосудистую проницаемость в дыхательных путях.
COVID-19 имеет различие в уровне смертности среди мужчин (2,8%) и женщин (1,7%) [32]. Так как ген АПФ 2 локализован на X-хромосоме, здесь могут быть аллели, обеспечивающие устойчивость к COVID-19, что объясняет более низкую летальность среди женщин. Возможен и вариант, что эстроген и тестостерон имеют разные иммунорегуляторные функции, которые могут влиять на иммунную защиту или тяжесть заболевания [33].
Воспалительный иммунопатогенез
- Цитопатические вирусы, включающие SARS-CoV-2, индуцируют гибель и повреждение инфицированных вирусом клеток и тканей, как часть жизненного цикла вируса. Вирусные инфицирование и репликация в эпителиальных клетках [34] дыхательных путей могут вызвать высокие уровни связанного с вирусом пироптоза и ассоциированной увеличенной проницаемости сосудов, что наблюдается у пациентов с SARS-CoV [35].
- Используя множество паттерн-распознающих рецепторов (PRRs), альвеолоциты и альвеолярные макрофаги опознают выделенные патоген-ассоциированные молекулярные паттерны (PAMPs), такие как вирусная РНК, а также молекулярные паттерны, ассоциированные с повреждением (DAMPs), включающие АТФ, ДНК и олигомеры апоптоз-ассоциированного Speck-подобного белка, содержащего CARD (ASC). В результате возникает волна местного воспаления, включающая увеличенную секрецию провоспалительных цитокинов и хемокинов IL-6, IFNγ, MCP1 и IP-10 в кровь поражённых болезнью пациентов [10,21]. Эти цитокины являются индикаторами клеточного иммунного ответа. Параллельные наблюдения были сделаны для SARS-CoV и MERS-CoV [36].
- Вовлечение легкими иммунных клеток из крови и инфильтрация лимфоцитами дыхательных путей могут объяснить лимфопению и увеличенное нейтрофил-лимфоцитарное соотношение наблюдается примерно у 80% пациентов с SARS-CoV-2 инфекцией [5,37].
- Также пациенты с тяжёлым течением показывают более высокий процент CD14+CD16+ воспалительных моноцитов в периферической крови, чем пациенты с лёгким течением [38]. Эти клетки выделяют воспалительные цитокины, которые способствуют воспалительному шторму, включая MCP1, IP-10 и MIP1α (рис.1).
- Антагонизм интерферонового ответа способствует вирусной репликации, что приводит к увеличенному высвобождению продуктов пироптоза, которые могут далее вызвать аберрантный иммунный ответ.
- Несдержанная воспалительная клеточная инфильтрация сама может опосредовать повреждение лёгких через избыточную секрецию протеаз и активных форм кислорода, в добавление к непосредственному вирусному повреждению. Все вместе это приводит к диффузному альвеолярному повреждению, включающему десквамацию альвеолоцитов, образованию гиалиновых мембран и отёку лёгких [39,40]. Это ограничивает эффективность газообмена в лёгких, вызывая затруднённое дыхание и пониженное содержание кислорода в крови. Лёгкие также становятся более подверженными вторичному инфицированию.
- В дополнение к местному повреждению, цитокиновый шторм также имеет косвенное воздействие на весь организм. Повышенные уровни цитокинов, таких как TNF, могут вызывать септический шок и полиорганную недостаточность. Это может привести к повреждению миокарда и сердечной недостаточности, наблюдаемые у некоторых пациентов [41]. Пожилые люди (чей возраст больше 60 лет) и люди с сопутствующими заболеваниями имеют большую вероятность развития такого дисфункционального иммунного ответа, который приводит к патологии, а также не может успешно избавиться от патогена.
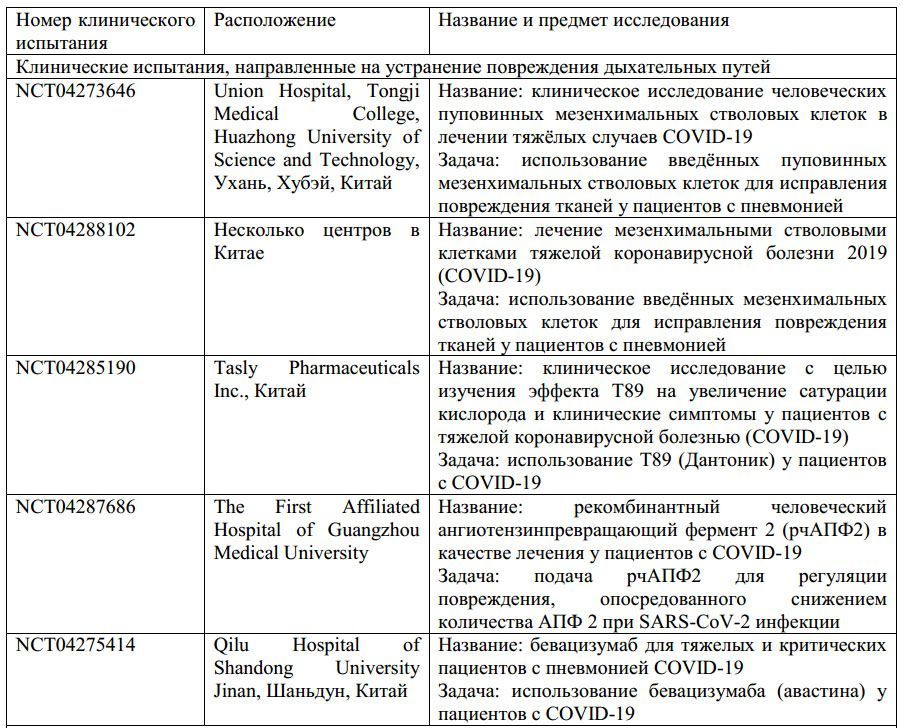
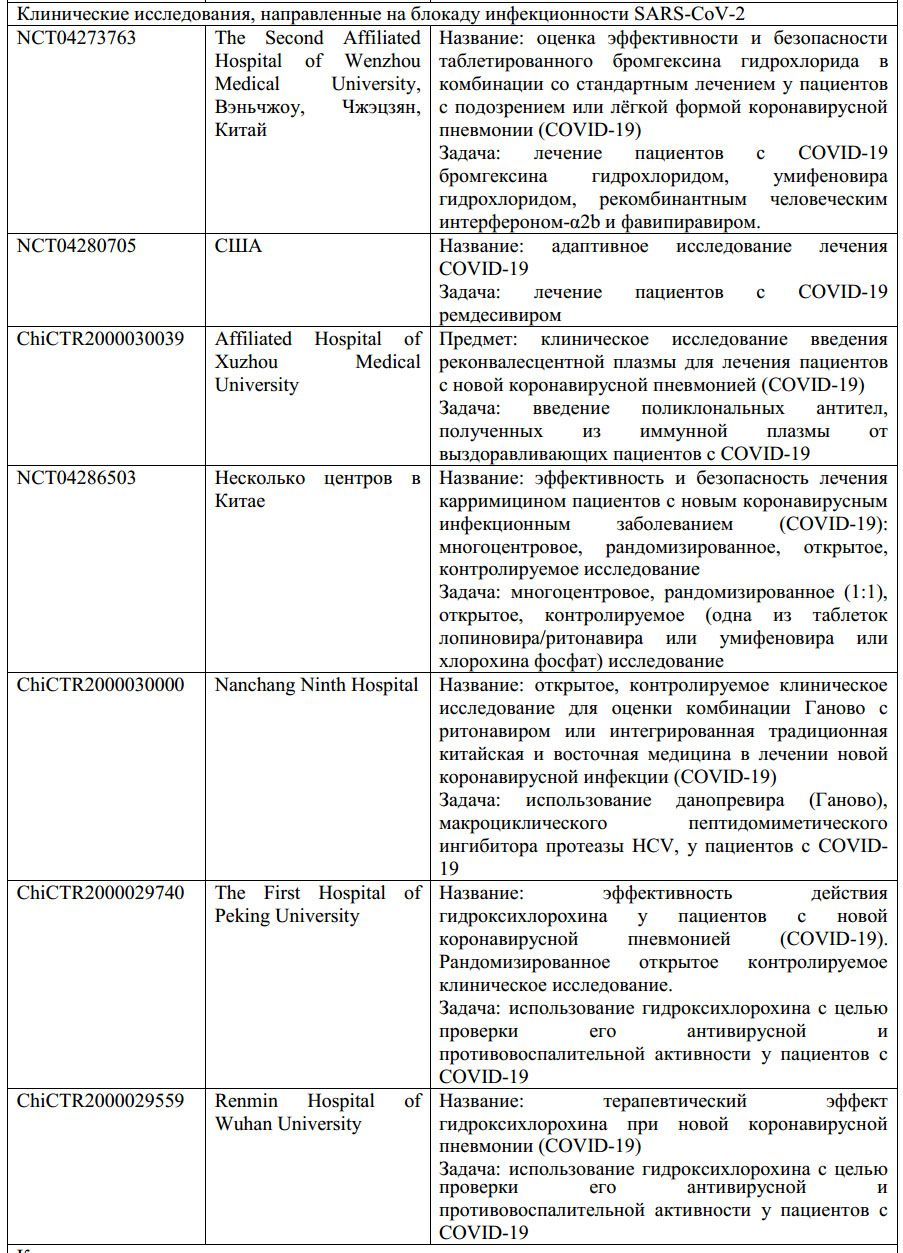
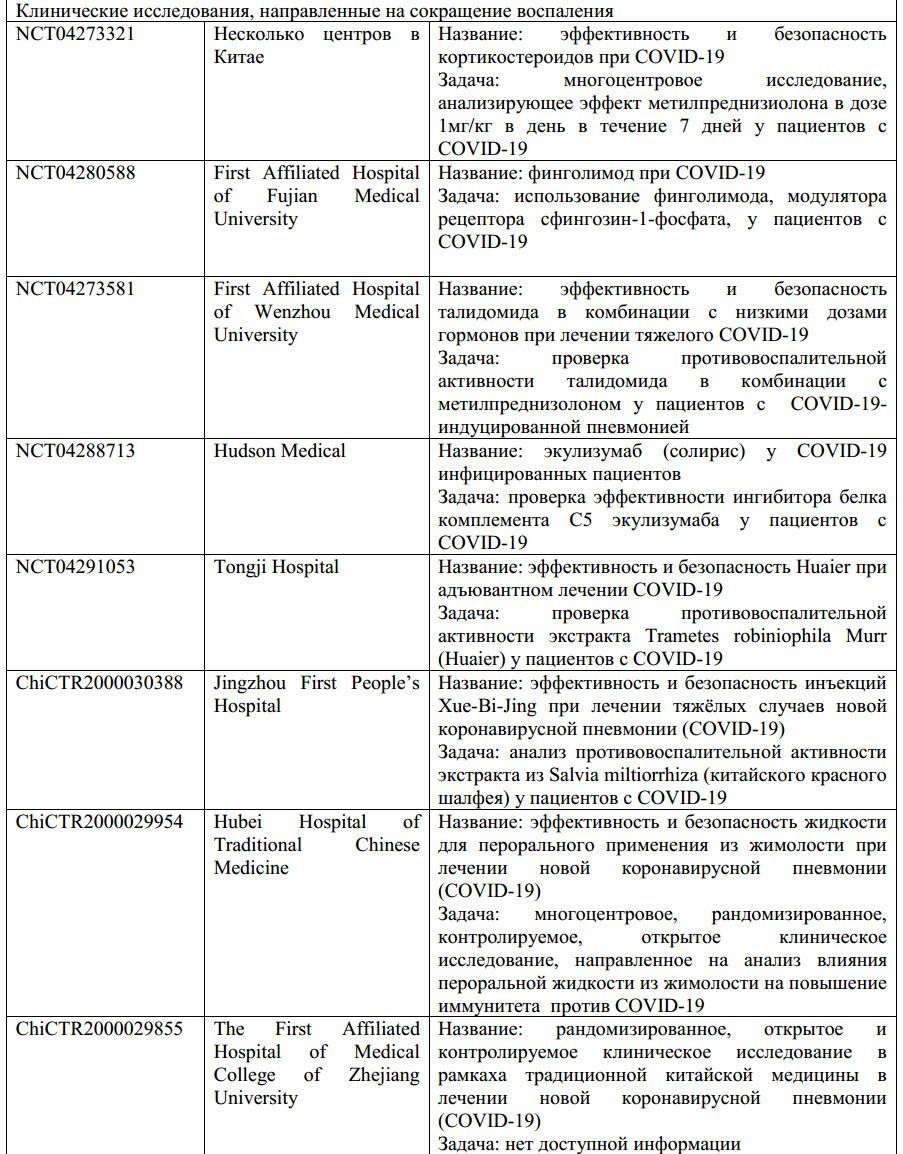
- Некоторые виды иммуносупрессивной терапии, направленные на ограничение иммуномедиаторного повреждения при COVID-19, находятся на разных фазах разработки и перечислены в табл.1. На сегодняшний день, проводятся исследования кортикостероидов для лечения COVID-19 [42], хотя этот вид лечения не был рекомендован во время эпидемии SARS в 2003 году [43,44]. Также проводится клиническое исследование эффективности антагониста IL-6 тоцилизумаба [45], а также исследуется сарилумаб [46]. Другие клинические исследования также проверяют эффекты поражения гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), включая использование гимсилумаба [47], лензилумаба [48] и намилумаба [49]. Другая новая дополнительная терапия - это цитосорб [50], который действует путём абсорбции широкого спектра цитокинов, DAMPs и PAMPs, чтобы сократить их уровень в циркулирующей крови и сгладить иммунопатологию. Талидомид, агент с иммуномодуляторными свойствами, также был успешно применён у одного пациента с COVID-19 [51]. В результате два клинических испытания были начаты, чтобы проверить его способность сокращать повреждение лёгких [52,53]. Был предположен TNF антагонизм, но не тестирован в условиях SARS-CoV инфекции, а также еще не был проверен у пациентов с COVID-19 [54]. Маленькое открытое нерандомизированное исследование предположило, что комбинация гидроксихлорохина (известного антималярийного препарата) и азитромицина (обычного антибиотика) может быть эффективна для лечения пациентов с тяжелым COVID-19 [55]. Хотя эффект гидроксихлорохина на прямое ингибирование вируса [56] и его антивоспалительные и иммуномодуляторные свойства известны [57], играют ли эти механизмы роль в борьбе против COVID-19 ещё предстоит определить [58].
Рис.3.
Потенциальные подходы к терапии против SARS-CoV-2. (1) Антитела против спайк-белка (появивщиеся в ходе вакцинации или адоптивного переноса) могут блокировать коронавирус тяжёлого острого респираторного синдрома 2, нарушая связывание с рецептором ангиотензинпревращающего фермента на клетках хозяина. (2) Протеазные ингибиторы против сериновой протеазы TMPRSS2 могут предотвратить деградацию спайк-белка, которая необходимо для слияния вируса с клеткой хозяина. Блокируя либо взаимодействие с АПФ 2, либо слияние вируса, можно предотвратить инфицирование клеток хозяина. (3) Вирус-специфичные CD8+ T-клетки памяти от предыдущей вакцинации или инфекции могут дифференцироваться в эффекторные клетки во время повторной антигенной стимуляции. Когда они идентифицируют инфицированные клетки, презентирующие вирус-специфичные эпитопы, они дегранулируют и убивают инфицированные клетки перед так, как они смогут продуцировать зрелые вирионы. (4) В новых методах лечения, которые действуют на симптомы цитокинового шторма, кровь пациентов с COVID-19 проводят через специализированные колонны, которые специально предназначены для захвата провоспалительных цитокинов перед тем, как очищенная кровь возвращается обратно в тело пациента.
Заключение
В этом обзоре были представлены различные механизмы SARS-CoV-2 инфекции и иммунопатогенез COVID-19. Контроль воспалительного ответа может иметь такую же важность, как и воздействие на вирус. Виды терапии, ингибирующие вирусное инфицирование и регуляцию дисфункционального иммунного ответа, могут действовать сообща, чтобы блокировать патологии на различных этапах. В то же время, связь между иммунной дисфункцией и исходом тяжести заболевания у пациентов с COVID-19 должна служить в качестве предостережения при создании и анализе вакцин. Дальнейшие исследования иммунного ответа организма при SARS-CoV-2 необходимы, включаядетальное исследование детерминант здоровых и дисфункциональных исходов. Это также поможет идентифицировать биомаркёры для определения иммунных коррелятов защиты и тяжести заболевания, чтобы эффективно разделять пациентов на потоки.
Таблица 1. Сводка одобренных интервенционных клинических испытаний
Информация с сайта ClinicalTrials.gov. COVID-19 – коронавирусное заболевание 2019; HCV – вирус гепатита С; рчАПФ2 – рекомбинантный человеческий ангиотензинпревращающий фермент 2; SARS-CoV-2 – коровирус тяжелого острого респираторного синдрома 2.
- Fehr, A. R. & Perlman, S. Coronaviruses: an overview of their replication and pathogenesis. Methods. Mol. Biol. 1282, 1–23 (2015).
- Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat. Microbiol. 5, 536–544 (2020).
- Zhou, P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270–273 (2020)
- Andersen, K. G., Rambaut, A., Lipkin, W. I., Holmes, E. C. & Garry, R. F. The proximal origin of SARS-CoV-2. Nat. Med. https://doi.org/10.1038/ s41591-020-0820-9 (2020).
- Guan, W. J. et al. Clinical characteristics of coronavirus disease 2019 in China. N. Engl. J. Med. https://doi. org/10.1056/NEJMoa2002032 (2020).
- Pung, R. et al. Investigation of three clusters of COVID-19 in Singapore: implications for surveillance and response measures. Lancet 395, 1039–1046 (2020).
- Lauer, S. A. et al. The incubation period of coronavirus disease 2019 (COVID-19) from publicly reported confirmed cases: estimation and application. Ann. Intern. Med. https://doi.org/10.7326/m20-0504 (2020).
- Li, Q. et al. Early transmission dynamics in Wuhan, China, of Novel Coronavirus-infected pneumonia. N. Engl. J. Med. 382, 1199–1207 (2020).
- Chan, J. F. et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet 395, 514–523 (2020).
- Huang, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 395, 497–506 (2020). This prospective study is the earliest to include an analysis of cytokine levels in severe and mild COVID-19, showing the presence of a cytokine storm analogous to that found for SARS-CoV infection.This prospective study is the earliest to include an analysis of cytokine levels in severe and mild COVID-19, showing the presence of a cytokine storm analogous to that found for SARS-CoV infection.
- Chen, G. et al. Clinical and immunologic features of severe and moderate coronavirus disease 2019. J. Clin. Invest. https://doi.org/10.1172/jci137244 (2020).
- Liu, Y. et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci. China Life Sci. 63, 364–374 (2020).
- Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 395, 507–513 (2020).
- Phan, L. T. et al. Importation and human-to-human transmission of a novel coronavirus in Vietnam.
- Pan, Y., Zhang, D., Yang, P., Poon, L. L. M. & Wang, Q. Viral load of SARS-CoV-2 in clinical samples. Lancet Infect. Dis. https://doi.org/10.1016/s1473- 3099(20)30113-4 (2020)
- Kim, J. Y. et al. Viral load kinetics of SARS-CoV-2 infection in first two patients in Korea. J. Korean Med. Sci. 35, e86 (2020).
- Zou, L. et al. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N. Engl. J. Med. 382, 1177–1179 (2020)
- Peiris, J. S. et al. Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study. Lancet 361, 1767–1772 (2003).
- Wang, D. et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirusinfected pneumonia in Wuhan, China. JAMA 323, 1061–1069 (2020)
- Wong, C. K. et al. Plasma inflammatory cytokines and chemokines in severe acute respiratory syndrome. Clin. Exp. Immunol. 136, 95–103 (2004).
- Zhang, B. et al. Clinical characteristics of 82 death cases with COVID-19. Preprint at medRxiv https://doi. org/10.1101/2020.02.26.20028191 (2020).
- Chu, K. H. et al. Acute renal impairment in coronavirus-associated severe acute respiratory syndrome. Kidney Int. 67, 698–705 (2005)
- Jia, H. P. et al. ACE2 receptor expression and severe acute respiratory syndrome coronavirus infection depend on differentiation of human airway epithelia. J. Virol. 79, 14614–14621 (2005).
- Xu, H. et al. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int. J. Oral. Sci. 12, 8 (2020).
- Hamming, I. et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J. Pathol. 203, 631–637 (2004).
- Zhao, Y. et al. Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov. Preprint at bioRxiv https://doi.org/10.1101/ 2020.01.26.919985 (2020).
- Walls, A. C. et al. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell https://doi. org/10.1016/j.cell.2020.02.058 (2020). Together with Wrapp et al. (2020), this article presents a cryo-electron microscopy structure of the SARS-CoV-2 spike glycoprotein used for cell entry, including an analysis of its receptor-binding kinetics and antigenicity with respect to SARS-CoV.
- Imai, Y. et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature 436, 112–116 (2005).
- Imai, Y., Kuba, K. & Penninger, J. M. The discovery of angiotensin-converting enzyme 2 and its role in acute lung injury in mice. Exp. Physiol. 93, 543–548 (2008).
- Kuba, K. et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat. Med. 11, 875–879 (2005).
- Kuba, K., Imai, Y. & Penninger, J. M. Angiotensin-converting enzyme 2 in lung diseases. Curr. Opin. Pharmacol. 6, 271–276 (2006).
- Epidemiology Working Group for NCIP Epidemic Response. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China. Chin. J. Epidemiol. 41, 145–151 (2020).
- Taneja, V. Sex hormones determine immune response. Front. Immunol. 9, 1931 (2018).
- Zhang, H. et al. Histopathologic changes and SARS-CoV-2 immunostaining in the lung of a patient with COVID-19. Ann. Intern. Med. https://doi.org/ 10.7326/m20-0533 (2020).
- Chen, I. Y., Moriyama, M., Chang, M. F. & Ichinohe, T. Severe acute respiratory syndrome coronavirus viroporin 3a activates the NLRP3 inflammasome. Front. Microbiol. 10, 50 (2019)
- Huang, K. J. et al. An interferon-gamma-related cytokine storm in SARS patients. J. Med. Virol. 75, 185–194 (2005)
- Qin, C. et al. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clin. Infect. Dis. https://doi.org/10.1093/cid/ciaa248 (2020)
- Zhou, Y. et al. Pathogenic T cells and inflammatory monocytes incite inflammatory storm in severe COVID-19 patients. Natl Sci. Rev. https://doi.org/ 10.1093/nsr/nwaa041 (2020).
- Xu, Z. et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir. Med. 8, 420–422 (2020). This study is the first to describe pathological findings in severe COVID-19 and demonstrates the aberrant immune cell infiltrates found in the lung.
- Tian, S. et al. Pulmonary pathology of early phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J. Thorac. Oncol. https://doi. org/10.1016/j.jtho.2020.02.010 (2020)
- Ruan, Q., Yang, K., Wang, W., Jiang, L. & Song, J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. https://doi.org/10.1007/ s00134-020-05991-x (2020).
- US National Library of Medicine. ClinicalTrials.gov https://clinicaltrials.gov/ct2/show/NCT04273321 (2020).
- Stockman, L. J., Bellamy, R. & Garner, P. SARS: systematic review of treatment effects. PLoS Med. 3, e343 (2006).
- Tai, D. Y. Pharmacologic treatment of SARS: current knowledge and recommendations. Ann. Acad. Med. Singap. 36, 438–443 (2007).
- Chinese Clinical Trial Register. Chictr.org.cn http:// www.chictr.org.cn/showproj.aspx?proj=49409 (2020).
- Liu, A. China turns Roche arthritis drug Actemra against COVID-19 in new treatment guidelines. FiercePharma https://www.fiercepharma.com/pharmaasia/china-turns-roche-arthritis-drug-actemra-againstcovid-19-new-treatment-guidelines (2020).
- Roivant Sciences. Roivant announces development of anti-GM-CSF monoclonal antibody to prevent and treat acute respiratory distress syndrome (ARDS) in patients with COVID-19. Roivant Sciences https:// roivant.com/roivant-announces-development-of-antigm-csf-monoclonal-antibody-to-prevent-and-treatacute-respiratory-distress-syndrome-ards-in-patientswith-covid-19/ (2020).
- Humanigen. Humanigen partners with CTI, a leading contract research organization, for planned phase III study for lenzilumab for coronavirus treatment. Humanigen https://www.humanigen.com/press/ Humanigen-Partners-With-CTI%2C-A-LeadingContract-Research-Organization%2C-For-PlannedPhase-III-Study-For-Lenzilumab-For-CoronavirusTreatment (2020).
- Izana Bioscience. Initiation of two-centre compassionate use study involving namilumab in the treatment of individual patients with rapidly worsening COVID-19 infection in Italy. Izana Bioscience https://izanabio. com/initiation- of-two-centre-compassionate-use-studyinvolving-namilumab-in-the-treatment-of-individualpatients-with-rapidly-worsening-covid-19-infection-initaly/ (2020).
- CytoSorbents Corportation. CytoSorb, the Wuhan coronavirus, and cytokine storm. PR Newswire https:// www.prnewswire.com/news-releases/cytosorb-thewuhan-coronavirus-and-cytokine-storm-300994196. html (2020).
- Chen, C. et al. Thalidomide combined with low-dose glucocorticoid in the treatment of COVID-19 pneumonia. Preprints https://www.preprints.org/ manuscript/202002.0395/v1 (2020).
- US National Library of Medicine. ClinicalTrials.gov https://clinicaltrials.gov/ct2/show/NCT04273581 (2020).
- US National Library of Medicine. ClinicalTrials.gov https://clinicaltrials.gov/ct2/show/NCT04273529 (2020).
- Tobinick, E. TNF-alpha inhibition for potential therapeutic modulation of SARS coronavirus infection. Curr. Med. Res. Opin. 20, 39–40 (2004).
- Gautret, P. et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int. J. Antimicrob. Agents https://doi.org/10.1016/j.ijantimicag.2020.105949 (2020).
- Yao, X. et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin. Infect. Dis. https:// doi.org/10.1093/cid/ciaa237 (2020).
- Shukla, A. M. & Wagle Shukla, A. Expanding horizons for clinical applications of chloroquine, hydroxychloroquine, and related structural analogues. Drugs Context. 8, 2019-9-1 (2019).
- Cortegiani, A., Ingoglia, G., Ippolito, M., Giarratano, A. & Einav, S. A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19. J. Crit. Care https://doi.org/10.1016/j.jcrc.2020.03.005 (2020)