Сравнение эффективности флувоксамина по сравнению с плацебо и ухудшение клинического состояния у амбулаторных пациентов с симптомами COVID-19

Оригинал: JAMA Network
Авторы: Eric J. Lenze, MD; Caline Mattar, MD; Charles F. Zorumski, MD; et al.
Дата публикации: 12 ноября 2020, JAMA Network
Перевод: Ольга Лыскова, Фонд медицинских решений “Не напрасно!”
КЛЮЧЕВЫЕ МОМЕНТЫ
Вопрос: предотвращает ли флувоксамин, селективный ингибитор обратного захвата серотонина и агонист рецептора σ-1, клиническое ухудшение у амбулаторных пациентов с острым коронавирусным заболеванием 2019 года (COVID-19)?
Результаты в данном рандомизированном исследовании, включавшем в себя 152 взрослых амбулаторных пациента с подтвержденным COVID-19 и проявлением симптомов в течение 7 дней, клиническое ухудшение произошло у 0 пациентов, получавших флувоксамин, против 6 (8,3%) пациентов, получавших плацебо в течение 15 дней, что является статистически значимым различием.
Значение в этом исследовании, взрослые амбулаторные пациенты с симптоматическим COVID-19, получавшие флувоксамин, по сравнению с плацебо, имели более низкую вероятность клинического ухудшения в течение 15 дней; однако определение клинической эффективности потребовало бы более крупных рандомизированных исследований с более точными показателями исхода.
АННОТАЦИЯ
Существенность. Коронавирусная болезнь 2019 года (COVID-19) может привести к серьезным заболеваниям в результате чрезмерного иммунного ответа. Флувоксамин может предотвратить ухудшение клинического состояния через стимуляцию рецептора σ-1, который регулирует выработку цитокинов.
Цель — определить, предотвращает ли флувоксамин, назначаемый во время лечения легкой формы COVID-19, ухудшение клинического состояния и уменьшает ли тяжесть заболевания.
Проект, клиническая база, участники. Полностью бесконтактное двойное слепое рандомизированное клиническое исследование флувоксамина в сравнении с плацебо. Участниками стали взрослые пациенты с подтвержденной тяжелой формой острой респираторной инфекцией коронавируса 2 синдрома, с появлением симптомов COVID-19 в течение 7 дней и насыщением кислородом 92% или более, не прошедшие госпитализацию и живущие дома. Сто пятьдесят два участника были зачислены из столичного района Сент-Луиса (Миссури и Иллинойс) с 10 апреля 2020 года по 5 августа 2020 года. Окончательная дата проведения последующих исследований—19 сентября 2020 года.
Лечение. Участники рандомизированно получали 100 мг флувоксамина (n = 80) или плацебо (n = 72) 3 раза в день в течение 15 дней.
Основные результаты и показатели эффективности. Первичным результатом было ухудшение клинического состояния в течение 15 дней по двум критериям из-за рандомизации исследования: (1) одышка или госпитализация из-за одышки или пневмонии и (2) насыщение кислородом менее 92% воздуха в помещении или потребность в дополнительном кислороде для достижения насыщения кислородом 92% или более.
Результаты. Из 152 пациентов, к которым применялся метод рандомизации, (средний возраст [SD] 46 [13] лет; 109 [72%] женщин) 115 (76%) завершили исследование. Ухудшение клинического состояния наблюдалось у 0 из 80 пациентов в группе флувоксамина и у 6 из 72 пациентов в группе плацебо (абсолютная разница, 8,7% [95% CI (доверительный интервал), 1,8% -16,4%] по данным анализа выживаемости; логранговый критерий P = 0,009). В группе флувоксамина наблюдались 1 серьезное побочное явление и 11 других побочных эффектов; в группе плацебо наблюдались 6 серьезных побочных явлений и 12 других побочных эффектов.
Выводы и релевантность. В этом предварительном исследовании взрослых амбулаторных пациентов с симптоматическим COVID-19, пациенты, получающие флувоксамин, по сравнению с пациентами, получающими плацебо, имели более низкую вероятность ухудшения клинического состояния в течение 15 дней. Однако исследование ограничено небольшим объемом выборки и короткой продолжительностью наблюдения, а определение клинической эффективности потребует более крупных рандомизированных исследований и исследований с более точными итоговыми показателями.
Регистрация испытаний ClinicalTrials.gov Индентификатор: NCT04342663.
ВВЕДЕНИЕ
Коронавирусная болезнь 2019 года (COVID-19), вызванная заражением новым тяжелым острым респираторным синдромом коронавирусом 2 (SARS-CoV-2), может привести к серьезному заболеванию, ведущему к госпитализации, поступлению в отделение интенсивной терапии и смерти1. Клиническое ухудшение обычно наступает на второй неделе болезни. Ранние исследования COVID-19 показали, что госпитализация чаще всего происходит в течение 8-10 дней с исходно легкими или умеренными симптомами.2-4 Дополнительные данные свидетельствуют о том, что повреждение легких от COVID-19 было связано с чрезмерной воспалительной реакцией, что побудило к многочисленным испытаниям иммуномодулирующих препаратов.5,6 Потенциальным механизмом иммунной модуляции является агонизм рецептора σ-1 (S1R).7 S1R-это белок-шаперон эндоплазматического ретикулума с различными клеточными функциями, включая регуляцию продукции цитокинов посредством его взаимодействия с датчиком стресса эндоплазматического ретикулума инозитол-требующим ферментом 1α (IRE1). Предыдущие исследования показали, что флувоксамин, селективный ингибитор обратного захвата серотонина (СИОЗС) с высоким сродством к S1R, 8 уменьшает повреждающие аспекты воспалительной реакции во время сепсиса через путь S1R-IRE1 и уменьшает шок в моделях мышиного сепсиса.
Флувоксамин является сильным агонистом S1R, 10, 11 обладает высокой липофильностью и быстрым внутриклеточным поглощением.12 В этом исследовании проверялось, может ли флувоксамин, назначаемый в качестве раннего лечения людям с легкой формой заболевания COVID-19, предотвратить клиническое ухудшение.
МЕТОДЫ
Это было двойное слепое плацебо-контролируемое рандомизированное клиническое исследование, в котором флувоксамин сравнивался с плацебо у взрослых амбулаторных пациентов с подтвержденной инфекцией SARS-CoV-2. Протокол испытания и план статистического анализа приведены в Приложении 1. Исследование было одобрено институциональным наблюдательным советом Вашингтонского университета в Сент-Луисе и проводилось в соответствии с Хельсинкской Декларацией 13, руководящими принципами надлежащей клинической практики и местными нормативными требованиями. Все участники предоставили информированное согласие посредством электронного или письменного согласия.
Организация исследования. Это испытание проводилось в столичном районе Большого Сент-Луиса (Восточная Миссури и Южный Иллинойс). Пациенты были набраны с 10 апреля 2020 года по 5 августа 2020 года. 30-дневная последующая оценка пострандомизации была завершена 19 сентября 2020 года. Это было полностью дистанционное (бесконтактное) клиническое исследование:14 участников были набраны с помощью электронных медицинских карт, рекомендаций врачей и других медицинских работников, рекламных объявлений об исследованиях вблизи центров тестирования COVID-19 и в отделениях неотложной помощи, рекомендаций коллег, веб-сайта исследования и сообщений в местных телевизионных и газетных изданиях. Участники были зачислены без учета пола, расы, этнической принадлежности или религии. Потенциальные участники проходили скрининг по электронной почте и телефону и предоставляли информированное согласие, как правило, в электронном виде.
Исследовательские материалы доставлялись пациентам, находящимся на карантине, в виде пакета, оставленного у их дверей, и материалы исследования состояли из исследуемого лекарства, монитора насыщения кислородом, автоматического монитора артериального давления и термометра. Затем участники самостоятельно оценивали с помощью оборудования, предоставленного и подтвердил, жизненные показатели в пределах диапазона (систолическое артериальное давление от 80 мм рт. ст. и 200 мм рт. ст., диастолического артериального давления-от 40 мм рт. ст. до 120 мм рт. ст., а частота пульса в диапазоне от 50 уд/мин до 120 уд/мин), беременность, состояния, при наличии показаний и насыщение кислородом 92% или больше. Сотрудники исследования позвонили участникам, проинформировали их о приемлемости и проинструктировали принять исследуемое лекарство. Исследование было нацелено на то, чтобы начать его в тот же день, когда участники впервые связались с исследовательской группой и прошли скрининг.
Весь сбор данных осуществлялся дважды в день с помощью опросов REDCap, рассылаемых пациентам по электронной почте, а также с помощью телефонного сбора данных в качестве резервной копии для обеспечения участия лиц, не имеющих доступа в интернет. Обследования регистрировали насыщение кислородом, жизненные показатели, приверженность к лекарствам и симптомы COVID-19. Фиксированные расовые и этнические категории использовались интервьюерами как часть демографической информации, собранной для характеристики выборки.
Одышка измерялась с помощью непрерывной шкалы (0 = симптом отсутствует и 10 = симптом очень тяжелый) с экологической мгновенной оценкой 15 (т. е. “насколько плох ваш симптом прямо сейчас?”). В течение первых 3 дней исследования ежедневно предпринимались попытки связаться по телефону, чтобы ответить на вопросы участников, решить любые вопросы, связанные с лекарствами, и поощрить завершение оценки. Дополнительные телефонные звонки проводились в каждом конкретном случае, когда данные опроса участников указывали на значения, выходящие за пределы диапазонов. Для участников, у которых обострилась болезнь COVID-19, сотрудники исследования рекомендовали им обратиться за медицинской помощью.
Участники. В исследование были включены взрослые, живущие в сообществе с инфекцией SARS-CoV-2, подтвержденной методом полимеразной цепной реакции, и имевшие симптомы в течение 7 дней после первой дозы исследуемого препарата (Рис.1). Критерии исключения включали наличие COVID-19, который требовал госпитализации или наличия первичной конечной точки с насыщением кислородом менее 92% воздуха в помещении на момент рандомизации. Другими критериями исключения были тяжелое основное заболевание легких (например, хроническая обструктивная болезнь легких или потребность в домашнем кислороде, интерстициальная болезнь легких, легочная гипертензия), декомпенсированный цирроз печени, застойная сердечная недостаточность (класс III или IV Нью-Йоркской ассоциации сердца) или иммунокомпрометированный (например, реципиент трансплантации твердых органов или донор, реципиент трансплантации костного мозга, СПИД или прием иммунодепрессантов биологических препаратов или высоких доз кортикостероидов [>20 мг/сут преднизолона]; дополнительные сведения приведены в Приложении 1).
Выборка. Пациенты были рандомизированы 1: 1 на флувоксамин или соответствующие капсулы плацебо. Были составлены рандомизационные графики, стратифицированные по возрасту (18-44, 45-54, 55-64 и ≥65 лет)16 и полу. Лечение было рандомизировано с использованием чередующихся размеров блоков 2 и 4. рандомизированное распределение проводилось с помощью REDCap, который отображал рандомизированное назначение руководителю лаборатории (J. S.), который готовил материалы исследования, включая исследуемый препарат или плацебо. Все эксперты по оценке результатов, исследователи и научные сотрудники, которые контактировали с участниками, были ослеплены назначением лечения участникам.
Лечение. Участники получали дозу 50 мг флувоксамина (или соответствующее плацебо) вечером сразу после базовой оценки и подтверждения приемлемости, затем в течение 2 дней в дозе 100 мг два раза в день по мере переносимости, а затем увеличивали дозу до 100 мг 3 раза в день по мере переносимости через 15 дней, после чего прекращали (дополнительные сведения приведены в Приложении 1). Этот диапазон доз определялся на основе аффинности связывания флувоксамина с S1R. 17 после завершения 15-дневного приема флувоксамина или плацебо участникам предоставлялась возможность получить 6-дневный открытый курс флувоксамина. Эта необязательная фаза открытой метки была изменением по сравнению с первоначальным протоколом исследования.
Первичные и вторичные конечные точки. Первичной конечной точкой было клиническое ухудшение, определяемое как (1) наличием одышки (то есть одышки) или госпитализацией по поводу одышки или пневмонии, так и (2) снижением насыщения кислородом (<92%) воздуха в помещении или дополнительной потребностью в кислороде для поддержания насыщения кислородом 92% или выше. Первичная конечная точка была подтверждена телефонным разговором с участниками и изучением медицинской документации. Для вторичных конечных точек эпизоды клинического ухудшения оценивались по новой 7-балльной шкале с 0, указывающим на отсутствие; 1, одышка и насыщение кислородом менее 92%, но не требуется дополнительный кислород; 2, одышка и насыщение кислородом менее 92% плюс дополнительный кислород; 3, насыщение кислородом менее 92% плюс дополнительный кислород и госпитализация, связанная с одышкой или гипоксией; 4, насыщение кислородом менее 92% плюс дополнительный кислород и госпитализация, связанная с одышкой или гипоксией, плюс поддержка ИВЛ менее 3 дней; 5, насыщение кислородом менее 92% плюс дополнительный необходимый кислород и госпитализация, связанная с одышкой или гипоксией, плюс поддержка ИВЛ, необходимая в течение не менее 3 дней; и 6, смерть. Также оценивалось количество дней, требующих дополнительного кислорода, госпитализации и ИВЛ.
Предварительно определенной вторичной конечной точкой в протоколе исследования была тяжесть симптомов в течение 15 дней исследования с использованием непрерывной шкалы наиболее тяжелых исходных симптомов каждого пациента по 11-балльной шкале (0 = симптом отсутствует и 10 = симптом очень тяжелый). Эта аналитическая стратегия была ошибочной e-Рис. 1 в Приложении 2), и мы не проводили дальнейших анализов. В качестве пост-специального анализа были изучены уровни тревожности, сообщаемые самим собой, и измерялись по той же 11-балльной шкале, поскольку тревога может быть связана с одышкой (e-Рис. 1 в Приложении 2). Клиническое ухудшение оценивалось с использованием порядковой шкалы Всемирной организации здравоохранения для испытаний COVID-19 (e-Рис. 1 в Приложении 2) 18.
Первичные и вторичные конечные точки были измерены с помощью самоотчетов участников двухдневных опросов в течение 15 дней после рандомизации, которые были подтверждены исследовательским персоналом с помощью телефонного контакта. Для участников, которые перестали отвечать на опросы до 15-го дня или которые достигли первичной конечной точки, медицинские записи и последующие звонки этим участникам использовались для определения того, достигли ли они первичной конечной точки. Для участников, достигших первичной конечной точки, больничные записи использовались для подтверждения конкретного использования медицинской помощи (например, дополнительное использование кислорода, продолжительность пребывания в больнице, поддержка ИВЛ). Неблагоприятные события и серьезные неблагоприятные события регистрировались каждый день с помощью самоотчета участников в течение 15 дней после рандомизации.
Через 30 дней после завершения 15-дневного исследования был проведен последующий опрос с вопросом: "посещали ли вы больницу или отделение неотложной помощи с момента вашего последнего исследования 30 дней назад?” Эта непредставленная конечная точка была подтверждена по телефону, электронной почте или электронной медицинской карте.
Статистический анализ. Пациенты были проанализированы в соответствии с рандомизированной группой. Исходя из мощности 80%, уровня α 0,05, скорости клинического ухудшения в группе плацебо 20% и снижения риска клинического ухудшения в группе флувоксамина на 75%, требовался общий объем выборки из 152 участников. Такая величина снижения риска была выбрана потому, что открытие большого эффекта имело бы большое клиническое значение и требовало дальнейшего изучения. Как указано в протоколе исследования, полный набор анализов включал только тех участников, которые были подтверждены приемлемыми и начали принимать исследуемое лекарство, что согласуется с принципами клинических испытаний инфекционных заболеваний. 19 Статистик исследования (L. Y.) проводил слепой анализ под наблюдением старшего биостатиста (J. P. M.) до снятия слепоты. Промежуточный анализ не проводился.
Первичным анализом был анализ выживаемости для первичного исхода (клиническое ухудшение) с использованием логарифмического теста. Этот анализ рассматривал участников априори как подвергшихся цензуре в тот день, когда они достигли первичного результата, или в последний день, когда они заполнили оценку результата. Была измерена частота пропусков для завершения обследования. Чтобы определить, была ли пропущенность неслучайной, доступные баллы непосредственно до и после каждого пропущенного балла и их среднее значение сравнивались с общим средним баллом как для одышки, так и для насыщения кислородом.
Из-за потенциальной ошибки типа I из-за множественных сравнений анализ вторичных конечных точек был исследовательским. Для всех анализов использовалась версия SAS 9.4 (SAS Institute Inc). Значимость была установлена как 2-хвостатый уровень α 0,05.
РЕЗУЛЬТАТЫ
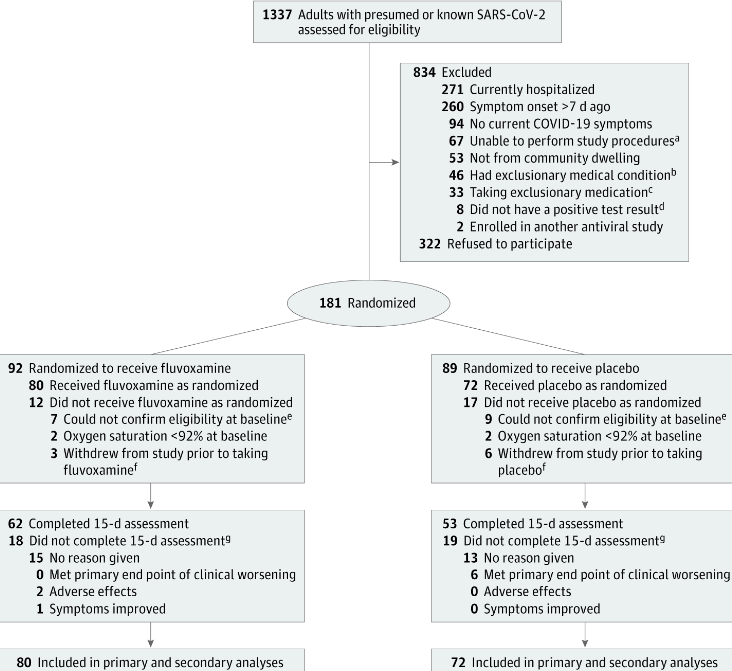
Характеристики пациента. Из 1337 обследованных пациентов 834 (62%) были исключены, 322 (24%) имели социальный контакт и отказались от участия, 181 (14%) были рандомизированы и обеспечены материалами исследования (Рис.1) Из 181 рандомизированного пациента 20 были исключены (9 в группе флувоксамина и 11 в группе плацебо), 9 никогда не принимали исследуемое лекарство (3 в группе флувоксамина и 6 в группе плацебо), а 152 начали исследование и составили основной набор анализа. Из 152 пациентов 140 (92%) приняли первую дозу исследуемого препарата в тот же день, когда с ними впервые связались сотрудники исследования (остальные начали его принимать на следующий день). В общей сложности 35 участников решили принять открытый флувоксамин после двойной слепой фазы, но сбор данных для этой фазы не проводился.
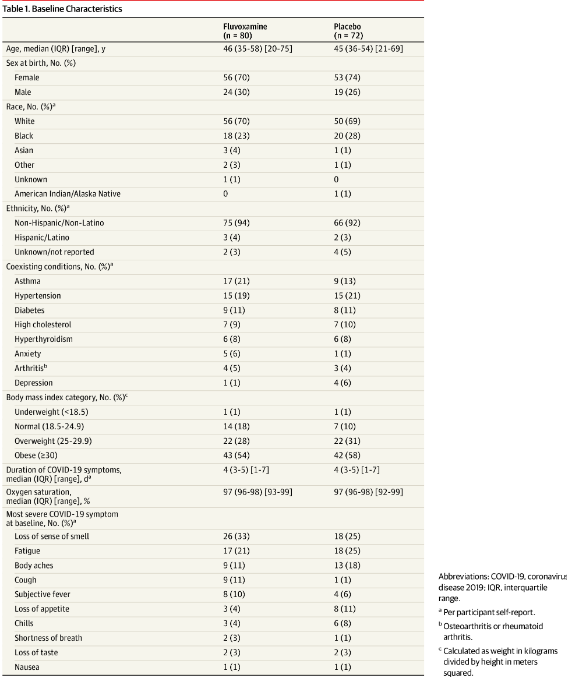
Участники были хорошо подобраны по демографическим и клиническим характеристикам (Табл.1). Из 152 участников 38 (25%) были чернокожими взрослыми, а средний возраст составил 46 лет (SD, 13 лет). Наиболее выраженный симптом COVID-19 менялся, наиболее распространенными были усталость (23%) и потеря обоняния (29%). Исходный уровень насыщения кислородом не различался между группами (медиана 97% [межквартильный диапазон, 96%-98%] для флувоксамина против 97% [межквартильный диапазон, 96% -98%] для плацебо (распределение показано на e-Рис.3 в Приложении 2).
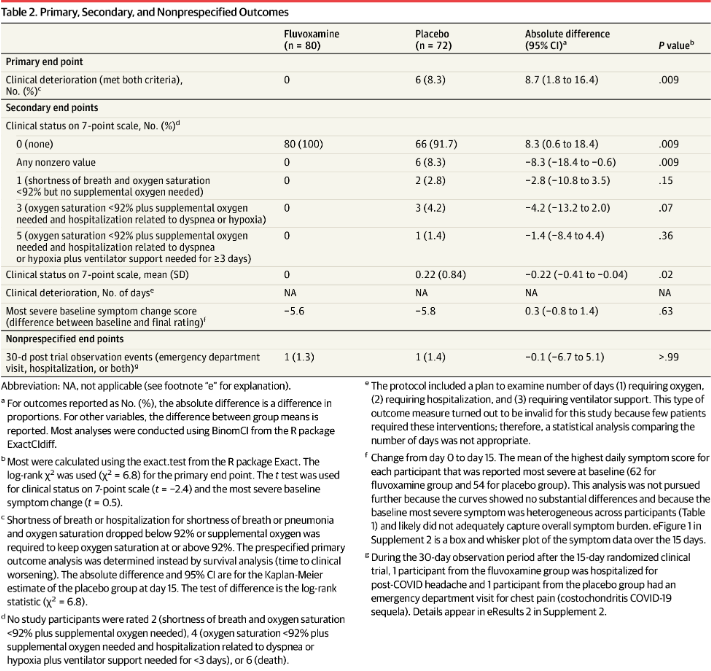
Эффективность флувоксамина по сравнению с плацебо. Ухудшение клинического состояния наблюдалось у 0 из 80 пациентов в группе флувоксамина и у 6 из 72 (8,3%) пациентов в группе плацебо (абсолютная разница-8,7% [95% CI 1,8% -16,4%] по данным анализа выживаемости, логранговый критерий χ2 = 6,8 и Р = 0,009; Табл.2 и Рис.2). В группе плацебо случаи ухудшения клинического состояния варьировали от 1 до 7 дней после рандомизации и от 3 до 12 дней после появления симптомов COVID-19. 4 из 6 пациентов были госпитализированы из-за COVID-19, причем продолжительность пребывания варьировалась от 4 до 21 дня. Одному пациенту требовалась искусственная вентиляция легких в течение 10 дней (Табл.2), ни один пациент не умер. Подробное описание ухудшения клинического состояния представлено в Результат 1 в Приложении 2.
Среди участников, получавших флувоксамин, 18 из 80 перестали отвечать на опросы до 15 дня по сравнению с 19 из 72 участников, которые были рандомизированы в группу плацебо. Что касается не представленных результатов лечения в больнице или отделении неотложной помощи, полученной в течение 30 дней после 15-го дня исследования, то среди участников, получавших флувоксамин, 1 из 80 получил медицинскую помощь (госпитализирован из-за головной боли) по сравнению с 1 из 72 участников, получавших плацебо (посещения отделения неотложной помощи из-за костохондрита) (Результаты 1 в Приложении 2).
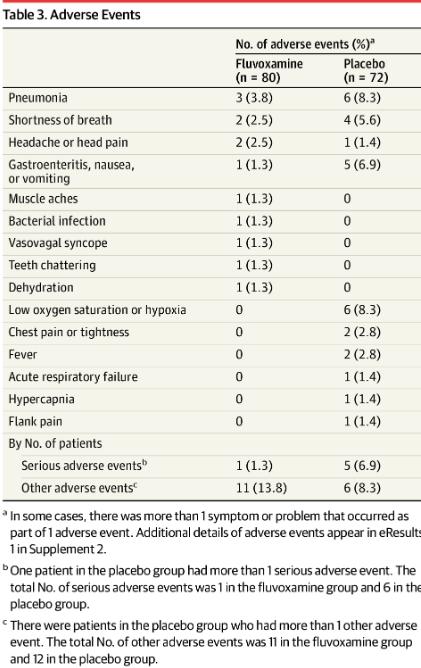
Побочные явления. Группа флувоксамина имела 1 серьезное побочное явление и 11 других побочных эффектов, в то время как группа плацебо имела 6 серьезных побочных явлений и 12 других побочных эффектов (Табл.3 и результаты 1 в Приложении 2). Пневмония и желудочно-кишечные симптомы (такие как тошнота и рвота) возникали чаще в группе плацебо по сравнению с теми, кто получал флувоксамин.
Отсутствующие данные. Что касается отсутствующих данных, то участники не заполнили 517 из 3943 последующих опросов (13%). Средний балл для тех, у кого отсутствовали данные (0,80), не отличался от общего среднего балла для одышки (0,83), а медиана составила 0 как для отсутствующих данных, так и для общего среднего бала. Средний балл насыщения кислородом составил 97,3% как для тех, у кого отсутствуют данные, так у остальных, а медиана составила 98% для обеих групп. Таким образом, данные отсутствовали случайным образом, и расчет данных не производился. Для участников, которые перестали отвечать на опросы до 15 дня, потому что они достигли первичной конечной точки или по другим причинам (Рис.1), данные были подвергнуты цензуре. Никто из 31 человека, которые перестали отвечать на опросы до 15 дня по другим причинам, не получал медицинской помощи в больнице или отделении неотложной помощи в связи с ухудшением состояния из-за COVID-19. Однако для 6 из этих людей мы не могли исключить возможность того, что они получали помощь в центре неотложной помощи, который находился за пределами основных региональных больничных систем.
ОБСУЖДЕНИЕ
В этом предварительном рандомизированном клиническом исследовании флувоксамин (агонист S1R) был связан со снижением ухудшения клинического состояния у взрослых амбулаторных пациентов с COVID-19. Ни один пациент, получавший флувоксамин, не соответствовал критериям, отмечающим ухудшение клинического состояния, определенным в исследовании, тогда как 8,3% пациентов, принимавших плацебо, соответствовали этой конечной точке. Однако из-за ограниченности исследования эти результаты следует интерпретировать как гипотезу, но не демонстрацию эффективности.
Данное двойное слепое плацебо-контролируемое рандомизированное клиническое исследование продемонстрировало возможность проведения полностью удаленного (бесконтактного) исследования во время пандемии COVID-19. Взрослые амбулаторные пациенты с COVID-19 находятся на карантине, но мало исследований посвящено уходу за этой уязвимой группой населения. Данный дизайн включал короткий период времени от появления симптомов до первой дозы лекарства (в среднем, 4 дня), эффективное начало лечения в рамках исследования (92% приняли первую дозу в тот же день, когда с ними связались) и репрезентативную выборку по расе и полу [20].Исследование потребовало примерно 4500 часов рабочего времени персонала и 30 часов времени на каждого участника.
Если флувоксамин будет признан эффективным в лечении COVID-19, основной механизм требует дальнейшего уточнения. Исследование было вызвано гипотезой о влиянии флувоксамина на путь S1R-IRE1. Противовоспалительное действие (снижение цитокинов), возникающее в результате активации S1R, согласуется с недавними открытиями преимуществ других противовоспалительных препаратов, таких как колхицин и кортикостероиды, при COVID-19 [21, 22]. Однако недавнее исследование показало более низкие уровни цитокинов у пациентов с тяжелым COVID-19 по сравнению с пациентами с бактериальным сепсисом [23]. Альтернативные механизмы потенциальной пользы флувоксамина включают прямые противовирусные эффекты за счет его лизосомотропных свойств, [24] модуляцию эффекта IRE1 на аутофагию, [25] и ингибирование SSRI активации тромбоцитов [26].
Потенциальные преимущества флувоксамина для амбулаторного лечения COVID-19 включают его безопасность, [27] широкую доступность, низкую стоимость и пероральный прием. Флувоксамин не способствует удлинению интервала QT, в отличие от других СИОЗС [28]. Однако флувоксамин имеет побочные эффекты и может вызывать лекарственные взаимодействия, в частности, за счет ингибирования цитохромов P450 1A2 и 2C19 [29].
Ограничения. Данное исследование имеет ряд ограничений. Во-первых, это было небольшое исследование проводилось в пределах одной географической области, поэтому данные выводы следует рассматривать как предварительные. Исследование необходимо повторить в более крупных исследованиях с более гетерогенной популяцией.
Во-вторых, небольшое количество конечных событий делает выводы недостаточно точными. В-третьих, возможно, что различия в степени ухудшения клинического состояния могли быть скорее отражением сравнительных исходных распределений насыщения кислородом, чем результатом эффективного лечения.
В-четвертых, метод измерения наиболее тяжелого исходного симптома с течением времени, по-видимому, не дал достоверных данных, поэтому насколько эффективно влияние флувоксамина на снятие симптомов пока неизвестно. В-пятых, 20% участников исследования перестали отвечать на опросы во время 15-дневного испытания. Хотя было подтверждено, что ни один из этих участников не нуждался в медицинской помощи, например, в госпитализации или посещении отделения неотложной помощи, возможно, что некоторым из них была оказана помощь в центре неотложной помощи за пределами основных региональных больничных систем.
В-шестых, продолжительность наблюдения была короткой и не оценивала влияние флувоксамина на стойкие симптомы или позднее ухудшение клинического состояния. Например, у людей с COVID-19 может развиться повреждение миокарда, [30] которое может иметь легкую степень тяжести или быть стойким, даже при легкой форме заболевания или в случаях выздоровления [31]. Поскольку агонисты S1R оказывают кардиозащитное действие на грызунов [32] и защитное действие на другие ткани, [33] будущие испытания лечения COVID-19 должны изучить долгосрочные результаты и показатели сердечно-легочной функции. В-седьмых, 7-балльная порядковая шкала, созданная для этого исследования для классификации степени ухудшения клинического состояния, не была утверждена официально.
ЗАКЛЮЧЕНИЕ
В этом предварительном исследовании взрослых амбулаторных пациентов с симптоматическим COVID-19 пациенты, получавшие флувоксамин, по сравнению с плацебо имели более низкую вероятность клинического ухудшения в течение 15 дней. Однако исследование ограничено небольшим объемом выборки и короткой продолжительностью наблюдения, а определение клинической эффективности потребует более крупных рандомизированных исследований с более точными показателями исхода.
ЛИТЕРАТУРА
- Wiersinga WJ, Rhodes A, Cheng AC, et al. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19). (Патофизиология, передача, диагностика и лечение коронавирусной болезни 2019 года (COVID-19) JAMA. 2020;324(8):782-793.
- Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. (Клиническая характеристика коронавирусной болезни 2019 года в Китае.) N Engl J Med. 2020;382(18):1708-1720.
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. (Клинические особенности пациентов, инфицированных новым коронавирусом 2019 года в г. Ухане, Китай.) Lancet. 2020;395(10223):497-506
- Lescure FX, Bouadma L, Nguyen D, et al. Clinical and virological data of the first cases of COVID-19 in Europe. (Клинические и вирусологические данные о первых случаях заболевания COVID-19 в Европе.) Lancet Infect Dis. 2020;20(6):697-706.
- Mehta P, McAuley DF, Brown M, et al. COVID-19: consider cytokine storm syndromes and immunosuppression. (COVID-19: рассмотрим синдромы цитокинового шторма и иммуносупрессию) Lancet. 2020;395(10229):1033-1034.
- Prasad A, Prasad M. Single virus targeting multiple organs. (Один вирус, нацеленный на несколько органов.) Front Med (Lausanne). 2020;7:370.
- Nicol GE, Karp JF, Reiersen AM, et al. “What were you before the war?”(Кемвыбылидовойны) J Clin Psychiatry. Published online April 7, 2020.
- Ishima T, Fujita Y, Hashimoto K. Interaction of new antidepressants with sigma-1 receptor chaperones and their potentiation of neurite outgrowth in PC12 cells. (Взаимодействие новых антидепрессантов с шаперонами Сигма-1 рецепторов и их потенцирование роста нейритов в клетках PC12) Eur J Pharmacol. 2014;727:167-173.
- Rosen DA, Seki SM, Fernández-Castañeda A, et al. Modulation of the sigma-1 receptor-IRE1 pathway is beneficial in preclinical models of inflammation and sepsis. (Модуляция пути sigma-1 рецептора-IRE1 полезна в доклинических моделях воспаления и сепсиса). Sci Transl Med. 2019;11(478):eaau5266.
- Hashimoto K. Activation of sigma-1 receptor chaperone in the treatment of neuropsychiatric diseases and its clinical implication. (Активация шаперона Сигма-1 рецептора в лечении нервно-психических заболеваний и ее клиническое значение) J Pharmacol Sci. 2015;127(1):6-9.
- Cobos EJ, Entrena JM, Nieto FR, et al. Pharmacology and therapeutic potential of sigma(1) receptor ligands. Curr Neuropharmacol. 2008;6(4):344-366.
- Hallifax D, Houston JB. Saturable uptake of lipophilic amine drugs into isolated hepatocytes.(Насыщаемое поглощение липофильных Аминовых препаратов изолированными гепатоцитами.) Drug Metab Dispos. 2007;35(8):1325-1332.
- World Medical Association. World Medical Association Declaration of Helsinki. JAMA. 2013;310(20):2191-2194.
- Nicol GE, Piccirillo JF, Mulsant BH, Lenze EJ. Action at a distance. (Действиенарасстоянии) J Am Geriatr Soc. 2020;68(5):922-925.
- Mofsen AM, Rodebaugh TL, Nicol GE, et al. When all else fails, listen to the patient.(Когда все остальное терпит неудачу, прислушайтесь к пациенту.) JMIR Ment Health. 2019;6(5):e11845.
- CDC COVID-19 Response Team. Severe outcomes among patients with coronavirus disease 2019 (COVID-19). Morbid Mortal Weekly Rep. 2020;69(12):343-346.
- Ishikawa M, Ishiwata K, Ishii K, et al. High occupancy of sigma-1 receptors in the human brain after single oral administration of fluvoxamine. (Высокая активность Сигма-1 рецепторов в головном мозге человека после однократного перорального приема флувоксамина.) Biol Psychiatry. 2007;62(8):878-883.
- World Health Organization. Novel coronavirus. Accessed November 2, 2020. who.int
- Gillings D, Koch G. The application of the principle of intention-to-treat to the analysis of clinical trials. (Применение принципа намерения лечить к анализу клинических испытаний.) Drug Information J. 1991;25:411-424.
- Chastain DB, Osae SP, Henao-Martínez AF, et al. Racial disproportionality in Covid clinical trials. (Расовая непропорциональность в клинических испытаниях Covid.) N Engl J Med. 2020;383(9):e59.
- Deftereos SG, Giannopoulos G, Vrachatis DA, et al. Effect of colchicine vs standard care on cardiac and inflammatory biomarkers and clinical outcomes in patients hospitalized with coronavirus disease 2019. (Влияние колхицина против стандартной терапии на сердечные и воспалительные биомаркеры и клинические исходы у пациентов, госпитализированных с коронавирусной болезнью 2019 года) JAMA Netw Open. 2020;3(6):e2013136-e2013136.
- Sterne JAC, Murthy S, Diaz JV, et al. Association between administration of systemic corticosteroids and mortality among critically ill patients with COVID-19. (Связь между приемом системных кортикостероидов и смертностью среди тяжелобольных пациентов с COVID-19) JAMA. 2020;324(13):1330-1341.
- Kox M, Waalders NJB, Kooistra EJ, et al. Cytokine levels in critically ill patients with COVID-19 and other conditions. (Уровень цитокинов у критически больных пациентов с COVID-19 и другими состояниями.) JAMA. 2020;324(15):1565-1567.
- Homolak J, Kodvanj I. Widely available lysosome targeting agents should be considered as potential therapy for COVID-19. (Широко доступные агенты, нацеленные на лизосомы, следует рассматривать как потенциальную терапию COVID-19.) Int J Antimicrob Agents. 2020;56(2):106044.
- Fung TS, Liu DX. The ER stress sensor IRE1 and MAP kinase ERK modulate autophagy induction in cells infected with coronavirus infectious bronchitis virus. Virology. 2019;533:34-44.
- Schlienger RG, Meier CR. Effect of selective serotonin reuptake inhibitors on platelet activation. (Влияние селективных ингибиторов обратного захвата серотонина на активацию тромбоцитов.) Am J Cardiovasc Drugs. 2003;3(3):149-162.
- Omori IM, Watanabe N, Nakagawa A, et al. Efficacy, tolerability and side-effect profile of fluvoxamine for major depression. (Эффективность, переносимость и профиль побочных эффектов флувоксамина при тяжелой депрессии.) J Psychopharmacol. 2009;23(5):539-550.
- Assimon MM, Brookhart MA, Flythe JE. Comparative cardiac safety of selective serotonin reuptake inhibitors among individuals receiving maintenance hemodialysis. (Сравнительная кардиальная безопасность селективных ингибиторов обратного захвата серотонина у лиц, получающих поддерживающий гемодиализ) J Am Soc Nephrol. 2019;30(4):611-623.
- Christensen M, Tybring G, Mihara K, et al. Low daily 10-mg and 20-mg doses of fluvoxamine inhibit the metabolism of both caffeine (cytochrome P4501A2) and omeprazole (cytochrome P4502C19). (Низкие суточные дозы флувоксамина 10 мг и 20 мг ингибируют метаболизм как кофеина (цитохром Р4501А2), так и омепразола (цитохром Р4502С19) Clin Pharmacol Ther. 2002;71(3):141-152.
- Lippi G, Lavie CJ, Sanchis-Gomar F. Cardiac troponin I in patients with coronavirus disease 2019 (COVID-19). (Сердечный тропонин I у пациентов с коронавирусной болезнью 2019 года (COVID-19) Prog Cardiovasc Dis. 2020;63(3):390-391.
- Puntmann VO, Carerj ML, Wieters I, et al. Outcomes of cardiovascular magnetic resonance imaging in patients recently recovered from coronavirus disease 2019 (COVID-19). (Результаты сердечно-сосудистой магнитно-резонансной томографии у пациентов, недавно выздоровевших от коронавирусной болезни 2019 года (COVID-19)) JAMA Cardiol. Published online July 27, 2020.
- Hashimoto K. Sigma-1 receptor chaperone and brain-derived neurotrophic factor. (Шаперон рецептора Сигма-1 и нейротрофический фактор головного мозга.)Prog Neurobiol. 2013;100:15-29.
- Hosszu A, Antal Z, Lenart L, et al. σ1-receptor agonism protects against renal ischemia-reperfusion injury.(агонизм σ1-рецептора защищает от ишемически-реперфузионного повреждения почек.) J Am Soc Nephrol. 2017;28(1):152-165.
Рисунок 1.
Таблица 1
Таблица 2
Таблица 3