Результаты повторного анализа экспрессии РНК SARS-CoV-2 RNA среди пациентов, выздоровевших после COVID-19 с предшествующими отрицательными результатами

Автор: Flora Marzia Liotti, PhD, et al
Опубликовано: JAMA Intern Med 12.11.2020
Перевод: Снежанна Генинг, Фонд «Не напрасно!»
Некоторые пациенты, выздоровевшие от коронавирусной болезни COVID-19 с документально подтвержденными отрицательными результатами полимеразной цепной реакции (ОТ-ПЦР) на SARS-CoV-2 в реальном времени на момент выздоровления, впоследствии демонстрируют положительные результаты ОТ-ПЦР [1] [2] при отсутствии симптомов реинфекции [3]. Неизвестно, заразны ли такие пациенты и нужно ли помещать их на карантин. ПЦР в реальном времени не аналогично культивированию вируса и не позволяет определить жизнеспособность вируса и вероятность его передачи. Мы исследовали повторно протестированные с помощью ОТ-ПЦР положительные образцы мазков из носа/ротоглотки (МНР) выздоровевших пациентов с COVID-19 с предыдущими отрицательными результатами на присутствие репликативной РНК SARS-CoV-2 [4].
Методы
В исследование вошли 176 пациентов, наблюдавшихся в амбулаторном отделении нашего института (Рим, Италия) с 21 апреля по 18 июня 2020 года после выздоровления от COVID-19 [5, 6]. Ранее пациенты прекратили пребывание на самоизоляции согласно существующим критериям [5], которые включают отсутствие лихорадки в течение 3 дней подряд, улучшение других симптомов и 2 негативных результата теста ОТ-ПЦР к SARS-CoV-2 с разницей в 24 часа.
Образцы мазков из носа/ротоглотки, взятые у пациентов при наблюдении, были проанализированы на общую (геномную) и репликативную (субгеномную) РНК SARS-CoV-2 с помощью ОТ-ПЦР (eMethods в приложении). У пациентов с положительными результатами теста на общую РНК были также проанализированы на наличие репликативной РНК прежние образцы, полученные при первичной диагностике COVID-19 и хранившиеся при температуре -112 ° F. Было проведено серологическое тестирование для выявления SARS-CoV-2 IgG/IgA (eMethods в приложении). Исследование было одобрено комитетом по этике Fondazione Policlinico Universitario A. Gemelli IRCCS (Рим, Италия), и от каждого пациента было получено письменное информированное согласие.
Результаты
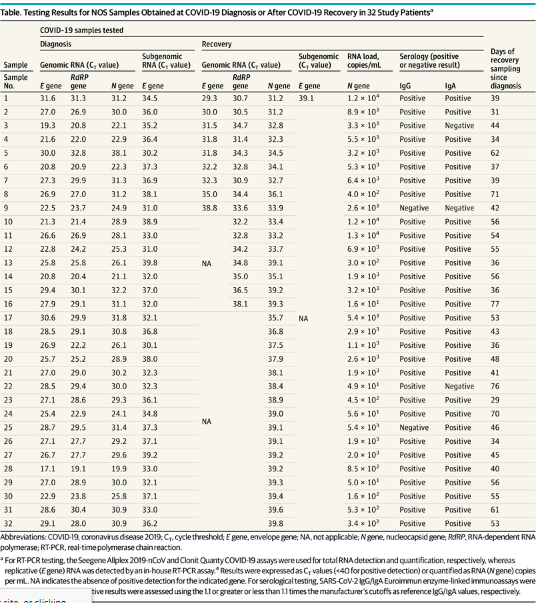
Как показано в таблице [4] , 32 из 176 МНР (18,2 %) оказались положительными при тестировании на общую РНК SARS-CoV-2; вирусная нагрузка варьировалась от 1,6×101 до 1,3×104 копий РНК SARS-CoV-2 на мл. Один из 32 образцов (3,1 %) содержал репликативную РНК SARS-CoV-2. Образцы от момента постановки диагноза COVID-19 у 32 пациентов также были протестированы и, как и ожидалось, содержали репликативную РНК SARS-CoV-2. У всех, кроме 1, из 32 пациентов серологический результат на SARS-CoV-2 был положительным (таблица), как и у 139 из оставшихся 144 пациентов (данные не представлены) в ходе наблюдения. Единственный пациент с серологически отрицательным результатом имел отрицательный результат теста на репликативную РНК SARS-CoV-2. Среднее (СО) время от диагноза COVID-19 до наблюдения составило 48,6 (13,1) дней у 32 пациентов (таблица) и 57,7 (16,9) дней у 144 пациентов (данные не представлены).
Обсуждение
В соответствии с данными других авторов [2], 18 % из пациентов нашего института с COVID-19 имели положительный тест ОТ-ПЦР на РНК SARS-CoV-2 после клинического выздоровления и ранее негативных тестов [5] . Поскольку положительные результаты ПЦР предполагают, но не обязательно отражают вирусное носительство, мы использовали обнаружение репликативной РНК SARS-CoV-2 в качестве замены теста репликации вируса в культуре [4].
Только у 1 из 32 пациентов, имевших положительный результат повторного тестирования, в мазке присутствовал реплицирующийся вирус, что указывает на рецидивирующую или повторную инфекцию, которые невозможно отдифференцировать в нашем исследовании, поскольку не было выполнено полногеномное секвенирование и филогенетический анализ [3]. Один пациент, имевший положительный результат повторного теста через 16 дней после выздоровления от COVID-19 (то есть через 39 дней после постановки диагноза COVID-19), имел симптомы. Этот пациент был пожилым человеком с гипертонией, диабетом и сердечно-сосудистой патологией, не имел в анамнезе тесных контактов с людьми с инфекцией SARS-CoV-2 или людьми с положительным результатом ОТ-ПЦР. У остальных 31 пациента (без симптомов) положительный результат, вероятно, свидетельствовал о рецидивирующей или разрешающейся инфекции; в любом случае они вряд ли были заразными. Ограничениями нашего исследования являются отсутствие данных из вирусных культур или полногеномного секвенирования, а также небольшой размер выборки.
Выводы
В этом исследовании показано, что многие пациенты, выздоровевшие от COVID-19, могут иметь положительный результат (хотя и с более низким уровнем экспрессии) теста на РНК SARS-CoV-2, однако лишь небольшая часть из них имеет реплицирующийся SARS-CoV-2 в дыхательных путях. Необходимы дальнейшие исследования, чтобы уточнить, могут ли такие пациенты передавать вирус другим.
Литература
- Lan L, Xu D, Ye G, et al. Positive RT-PCR test results in patients recovered from COVID-19. (Положительные результаты теста ОТ-ПЦР у пациентов, выздоровевших от COVID-19) JAMA. 2020;323(15):1502-1503. doi:10.1001/jama.2020.2783.
- Kang H, Wang Y, Tong Z, Liu X. Retest positive for SARS-CoV-2 RNA of “recovered» patients with COVID-19: Persistence, sampling issues, or re-infection? (Ретест положительный на РНК SARS-CoV-2 «выздоровевших” пациентов с COVID-19: персистенция, проблемы с отбором проб или повторное заражение?) J Med Virol. 2020;1-3. doi:10.1002/jmv.26114.
- Alvarez-Moreno CA, Rodríguez-Morales AJ. Testing dilemmas: post negative, positive SARS-CoV-2 RT-PCR—is it a reinfection? (Дилеммы тестирования: пост-отрицательная, положительная атипичная пневмония-2 от-ПЦР—это реинфекция?) Travel Med Infect Dis. 2020;35:101743. doi:10.1016/j.tmaid.2020.101743.
- Wölfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019. (Вирусологическая оценка госпитализированных пациентов с COVID-2019) Nature. 2020;581(7809):465-469. doi:10.1038/s41586-020-2196-x.
- Carfì A, Bernabei R, Landi F; for the Gemelli Against COVID-19 Post-Acute Care Study Group. Persistent symptoms in patients after acute COVID-19. (Против COVID-19 исследовательская группа по пост-острой помощи. Стойкие симптомы у пациентов после острого COVID-19.) JAMA. 2020;324(6):603-605. doi:10.1001/jama.2020.12603.
- Gemelli Against COVID-19 Post-Acute Care Study Group. Post-COVID-19 global health strategies: the need for an interdisciplinary approach. (Против COVID-19 послеоперационная исследовательская группа по уходу. Глобальные стратегии здравоохранения после COVID-19: необходимость междисциплинарного подхода) Aging Clin Exp Res. 2020;32(8):1613-1620.
Приложение
Клинические мазки из носа/ротоглотки (МНР) были собраны в универсальной транспортной среде (UTM; Copan Italia S. p.A., Brescia, Italy) и протестированы с помощью анализа обратной транскриптазы-полимеразы-цепной реакции в реальном времени (ОТ-ПЦР) для качественного или количественного обнаружения РНК SARS-CoV-2 (см. ниже) в соответствии с ранее описанными протоколами [1,2]. Процедуры предотвращения загрязнения образцов и переноса ПЦР проводились в соответствии со стандартной лабораторной практикой. Кроме того, образцы сыворотки, полученные из образцов крови, были использованы для серологического тестирования (см. ниже). Общая вирусная РНК была выделена из мазков МНР с помощью автоматизированной системы Seegene Nimbus, которая использует универсальный картриджный набор STARMag как для экстракции РНК, так и для ПЦР-анализа [1]. Затем было проведено тестирование ОТ-ПЦР с использованием одобренного Министерством пищевой и фармацевтической безопасности Кореи Seegene Allplex 2019-nCoV assay (Arrow Diagnostics, Genova, Italy)—однотрубный анализ, нацеленный на три вирусных гена (E, RdRP и N), как и в рекомендованных Всемирной Организацией Здравоохранения протоколах, и работает на системе обнаружения Bio-Rad CFX96 в реальном времени [1]. Каждый анализ ОТ-ПЦР обеспечивал порог цикла (CT)—количество циклов, необходимых для того, чтобы флуоресцентный сигнал пересек порог для положительного анализа,—и программное обеспечение автоматизированного анализа данных Seegene (Seegene Зритель) использовался для выявления положительных обнаружений. В частности, положительный результат (т. е. КТ менее 40) по крайней мере для одного из двух вирусных генов (т. е. RdRP и N) или только для Гена е указывает, соответственно, на определенное или предполагаемое присутствие РНК SARS-CoV-2 в в мазке МНР Количественное определение суммарной вирусной РНК проводили с помощью количественного анализа COVID-19 (Clonit S. r.l, Милан, Италия) [1]. Каждая лунка ПЦР-микропланшета была заполнена 5-мкл экстрагированной РНК образца (т. е. полученной на стадии экстракции Нимбовой РНК ), положительным контролем, отрицательным контролем и стандартами. Вирусную нагрузку в мазке МНР рассчитывали путем интерполяции соответствующего значения КТ со стандартной кривой, которая ранее строилась с учетом значений КТ, полученных следующим образом
ПЦР-амплификация образцов, содержащих 101
, 102
, 103
, 104
и 105
копий/мкл синтетической вирусной N1-кодирующей РНК соответственно [1]. Обнаружение РЕПЛИЦИРУЮЩЕЙ РНК SARS-CoV-2 для оценки наличия субгеномной вирусной РНК (т. е. Реплицирующей/промежуточной РНК Гена Е), которая предназначена в качестве суррогата для репликации вируса, образцы были подвергнуты внутреннему анализу ОТ-ПЦР, как описано в другом месте [2]. В частности, с использованием набора QIAGEN ® oneStep RT-PCR Kit (Qiagen, Valencia, CA, USA), 600 Нм концентрации каждого из двух праймеров (sgE_SARS-CoV2_F 5’-CGATCTCTTGTAGATCTGTTCTC-3’; sgE_SARS-CoV2_R 5’-ATATTG использовали в реакционном объеме 25 мкл. Термический цикл состоял из 30 мин при 50°C для обратной транскрипции, затем 15 мин при 95°C и последующих 45 циклов по 10 С при 95°C, 15 С при 55°C и 5 С при 72°C. Серологическое тестирование образцы сыворотки были протестированы с помощью коммерческого анализа (Euroimmun; Любек, Германия), ферментного иммуносорбентного анализа (ELISA), который использует рекомбинантный домен S1 белка Спайка (S) SARS-CoV-2 в качестве антигена для полуколичественного обнаружения антител IgG и IgA к SARS-CoV–2. По данным производителя инструкции, результаты оценивали путем расчета отношения экстинкции контрольного или сывороточного образца к экстинкции калибратора. Затем это соотношение интерпретировалось следующим образом: <1.1 - отрицательно; ≥1.1 - положительно.
Литература
- Liotti FM, Menchinelli G, Marchetti S, et al. Evaluation of three commercial assays for SARS-CoV-2 molecular detection in upper respiratory tract samples. (Оценка трех коммерческих анализов для молекулярного обнаружения SARS-CoV-2 в образцах верхних дыхательных путей.) Eur J Clin Microbiol Infect Dis. Published online September 4, 2020. doi: 10.1007/s10096-020-04025-0.
- Wölfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019. (Вирусологическая оценка госпитализированных пациентов с COVID-2019). Nature. 2020;581(7809):465-469. doi: 10.1038/s41586-020-2196-x.
Таблица. Результаты тестирования мазков из носа/ротоглотки (МНР), полученных при диагностике COVID-19 или после восстановления COVID-19 в 32 исследованиях.