Одобренный FDA препарат ивермектин ингибирует репликацию SARS-CoV-2 in vitro

Авторы: Leon Caly, Julian D. Druce, Mike G. Catton, David A. Jans, Kylie M. Wagstaf
Опубликовано: 03.04.2020.
Источник: Antiviral Research
Перевод: Ирина Лагерь, ФПР
Редакция: Дмитрий Сергеев, ФПР
Основные положения:
· Ивермектин является ингибитором возбудителя вируса COVID-19 (SARS-CoV-2) по данным in vitro исследований.
· Однократное применение способно вызывать уменьшение содержания вируса в 5000 раз за 48 часов в культуре клеток.
· Ивермектин одобрен FDA для лечения паразитарных инфекций и, следовательно, потенциально может использоваться после изменения показаний
· Ивермектин широко доступен благодаря его включению в Примерный перечень основных лекарственных средств ВОЗ.
Резюме
Несмотря на то, что в настоящее время проводится несколько клинических исследований для изучения возможных методов лечения, всемирная реакция на вспышку COVID-19 в значительной степени ограничивается мониторингом и политикой сдерживания. В этой работе мы сообщаем, что ивермектин, одобренный Управлением США по контролю за лекарствами и пищевыми продуктами (FDA) противопаразитарный препарат, для которого ранее была in vitro продемонстрирована противовирусная активность широкого спектра, является ингибитором возбудителя вируса (SARS-CoV-2): при однократном добавлении к культуре клеток линии Vero-hSLAM через 2 часа после заражения SARS-CoV-2 он был способен вызывать снижение уровня вирусной РНК в ~5000 раз через 48 часов. В связи с этим требуется дальнейшее изучение ивермектина в плане возможной пользы для человека.
Ивермектин является одобренным FDA противопаразитарным препаратом широкого спектра действия1, для которого в последние годы наша и другие группы исследователей продемонстрировали активность in vitro в отношении большого количества вирусов2, 3, 4, 5. Первоначально ивермектин был идентифицирован как ингибитор взаимодействия между белком интегразы (IN) вируса иммунодефицита человека-1 (ВИЧ-1) и гетеродимером импортина (IMP) α/β1, обеспечивающим импорт IN в ядро6, и в дальшейшем было подтверждено, что он ингибирует импорт IN в ядро и репликацию ВИЧ-15. Сообщалось о других эффектах ивермектина7, однако было показано, что ивермектин ингибирует также импорт в ядро как белков организма-хозяина (например, см. работы 8,9), так и вирусных белков, в том числе большого опухолевого антигена (T-ag) обезьяньего вируса SV40 и неструктурного белка-5 вируса лихорадки Денге (DENV)5,6. Важно отметить, что было продемонстрировано, что он ограничивает инфицирование РНК-вирусами, такими как вирус лихорадки Денге DENV 1-44, вирус лихорадки Западного Нила 10, венесуэльского лошадиного энцефалита (VEEV)3 и гриппа2. Считается, что такой широкий спектр активности обусловлен зависимостью многих различных РНК-вирусов от IMPα/β1 во время инфицирования11,12. Аналогичным образом было показано, что ивермектин эффективен в отношении ДНК вируса псевдобешенства (PRV) как in vitro, так и in vivo, при этом применение ивермектина повышает выживаемость у мышей, инфицированных вирусом псевдобешенства13. Эффективности ивермектина против вируса Зика (ZIKV) у мышей не наблюдалась, но авторы признали, что ограничения исследования обосновывают проведение повторной оценки активности ивермектина в отношении вируса Зика14. Наконец, ивермектин был в центре внимания во время проведения клинических исследований III фазы в Таиланде в 2014-2017 гг., в которых изучался его эффект в отношении лихорадки Денге. Было установлено, что однократный прием препарата внутрь является безопасным и приводит к значительному снижению уровня вирусного белка NS1 в сыворотке, однако никаких изменений в выраженности виремии или клинической картины не наблюдалось (см. ниже)15.
Возбудитель текущей пандемии COVID-19, SARS-CoV-2, представляет собой одноцепочечный (+) РНК вирус, который тесно связан с коронавирусом тяжелого острого респираторного синдрома (SARS-CoV). Исследования белков SARS-CoV выявили потенциальную роль IMP α/β1 во время инфицирования в сигнально-зависимом нуклеоцитоплазматическом закрытии нуклеокапсидного белка SARS-CoV16, 17, 18, что может влиять на деление клеток организма-хозяина19,20. Кроме того, было показано, что вспомогательный белок SARS-CoV ORF6 противодействует противовирусной активности фактора транскрипции STAT1 путем секвестрации IMP α/β1 на шероховатом эндоплазматическом ретикулуме/аппарате Гольджи21. В целом эти данные позволяют предположить, что ингибирующая активность ивермектина в отношении ядерного транспорта может быть эффективной в отношении SARS-CoV-2.
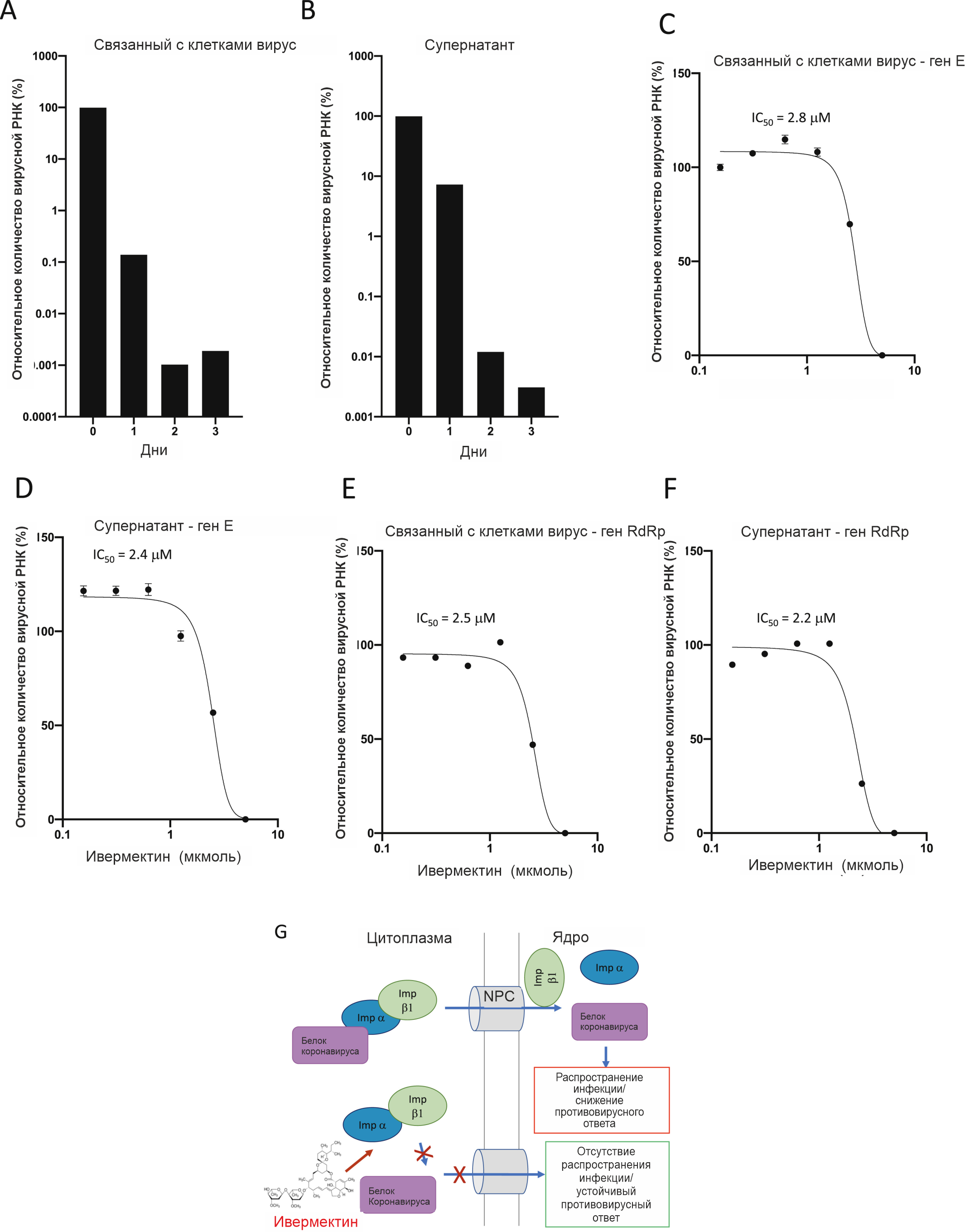
Чтобы изучить противовирусную активность ивермектина в отношении SARS-CoV-2, мы инфицировали клетки линии Vero/hSLAM штаммом SARS-CoV-2 Australia/VIC01/2020 при соотношении инфекционных агентов и здоровых клеток (MOI) 0,1 в течение 2 часов с последующим добавлением 5 мкмоль ивермектина. Супернатант и клеточный осадок собирали с 0-го по 3-й день и анализировали с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) для репликации РНК SARS-CoV-2 (рис. 1 A/B). Через 24 ч в супернатанте (позволяет оценить количество высвобожденных вирионов) образцов, обработанных ивермектином, наблюдалось снижение уровня вирусной РНК на 93% по сравнению с плацебо (диметилсульфоксид [ДМСО]). Аналогичным образом при применении ивермектина наблюдалось снижение уровня вирусной РНК, связанной с клетками, на 99,8% (позволяет оценить количество невысвободившихся и неупакованных вирионов). К 48 ч выраженность этого эффекта увеличилась: уровень вирусной РНК в образцах, на которые воздействовали ивермектином, уменьшился приблизительно в 5000 раз по сравнению с контрольными образцами, что указывает на то, что применение ивермектина приводило к эффективной потере практически всего вирусного материала через 48 часов. В соответствии с этой гипотезой, дальнейшего снижения уровня вирусной РНК через 72 ч не наблюдалось. Как мы наблюдали ранее [3, 4, 5], токсичности ивермектина не наблюдалось ни для одного из моментов времени ни в лунках для образцов, ни в параллельно тестируемых отдельных образцах препарата.
Рисунок 1.Ивермектин является мощным ингибитором клинического штамма SARS-CoV-2 Australia / VIC01/2020. Клетки линии Vero/hSLAM инфицировали клиническим штаммом SARS-CoV-2 Australia/VIC01/2020 (MOI = 0,1) в течение 2 ч до добавления плацебо (ДМСО) или ивермектина в указанных концентрациях. Образцы собирали с 0-го по 3-й день после инфицирования для количественной оценки вирусной нагрузки с использованием ПЦР в реальном времени для связанного с клетками вируса (А) или супернатанта (В). Значения IC50 определяли в последующих экспериментах через 48 ч после инфицирования с использованием указанных концентраций ивермектина (применялся через 2 ч после инфицирования, как указано в блоках A/B). Трёхкратная ПЦР в реальном времени проводилась для связанного с клетками вируса (C/E) или супернатанта (D/F) с использованием зондов к генам SARS-CoV-2 E (C/D) или RdRp (E/F). Результаты приведены в виде «среднее значение ± стандартное отклонение» (n = 3). Кривые зависимости «доза-ответ» для трех параметров были установлены с использованием программного обеспечения GraphPad Prism для определения значений IC50 (указано на рис.). G. Схема предполагаемого противовирусного действия ивермектина в отношении коронавируса. IMPα/β1 связывается с транспортным белком коронавируса в цитоплазме (вверху) и транслоцирует его через комплекс ядерных пор (NPC) в ядро, где комплекс распадается, и траспортированный вирус может снижать противовирусный ответ клетки организма-хозяина, что приводит к развитию инфекции. Ивермектин связывается с гетеродимером Imp α/β1 и дестабилизирует, тем самым предотвращая связывание Imp α/β1 с вирусным белком (внизу) и предотвращая его проникновение в ядро. Это, вероятно, приводит к снижению ингибирования противовирусного ответа и способствует развитию нормального, более эффективного противовирусного ответа.
Для дальнейшего определения эффективности ивемектина клетки, инфицированные SARS-CoV-2, обрабатывали серийными разведениями ивермектина через 2 ч после заражения, а супернатанты и клеточный осадок собирали для проведения ОТ-ПЦР в реальном времени через 48 ч (рис. 1 C/D). Как указано выше, уменьшение уровня вирусной РНК более чем в 5000 раз наблюдалось как в супернатанте, так и в клеточных осадках из образцов, обработанных ивермектином с кнцентрацией 5 мкмоль через 48 ч, что эквивалентно снижению уровня вирусной РНК в этих образцах на 99,98%. Как и ранее, токсичность ивермектина не наблюдалась ни для одной из протестированных концентраций. Было установлено, что IC50 для ивермектина в этих условиях составляла ~ 2 мкмоль. Для того, чтобы подчеркнуть тот факт, что при анализе действительно был обнаружен SARS-CoV-2, ОТ-ПЦР была проведена повторно с использованием праймеров, специфичных для вирусного гена RdRp (Рис. 1 E/F), а не гена E (см. выше). Были получены почти идентичные результаты как для высвобожденного (в супернатанте), так и для связанного с клетками вируса.
В целом, эти результаты показывают, что ивермектин обладает in vitro противовирусным действием в отношении клинического штамма SARS-CoV-2, при этом однократное применение препарата позволяло контролировать репликацию вируса в нашей системе в течение 24–48 ч. Мы предполагаем, что это возможно благодаря ингибированию опосредованного IMPα/β1 импорта в ядро вирусных белков (рис. 1 G), как показано для других РНК-вирусов 4,5,10; Подтверждение этого механизма в случае SARS-CoV-2 и идентификация конкретного компонента SARS-CoV-2 и/или компонента(ов) клетки организма-хозяина, на которые воздействует препарат (см. 10), является важным направлением будущей работы в этой лаборатории. В конечном счете, разработка эффективного противовирусного препарата для SARS-CoV-2, который назначается пациентам на ранних стадиях инфекции, может помочь ограничить вирусную нагрузку, предотвратить прогрессирование заболевания с развитием тяжёлого состояния и ограничить передачу вируса от человека человеку. Таким образом, важно как можно скорее начать тестирование ивермектина в сравнении с другими потенциальными противовирусными препаратами для SARS-CoV-2 с альтернативными механизмами действия22,23,24,25,26. В этом кратком сообщении продемонстрирована вероятность того, что ивермектин может быть полезным противовирусным средством для ограничения распространения SARS-CoV-2, подобно тому, как сообщалось ранее22,23,24,25,26; пока не будет выявлена польза от клинического применения одного из этих препаратов, такое тестирование должно быть выполнено как можно быстрее.
Ивермектин обладает изученным профилем безопасности при применении у человека1,12,27 и одобрен FDA для лечения ряда паразитарных инфекций1,27. Важно отметить, что недавние обзоры и метаанализ показывают, что ивермектин в высоких дозах обладает сопоставимой безопасностью с применением его в стандартных, низких дозах, однако нет достаточных доказательств, чтобы сделать выводы о профиле безопасности препарата при беременности28,29. Следующим важным шагом в дальнейшей оценке возможной пользы от применения препарата у пациентов с COVID-19 в режиме с многократным добавлением дозы, который имитирует текущий одобренный режим применения ивермектина у человека. Как уже отмечалось, ивермектин недавно изучался в клиническом исследовании III фазы у пациентов с лихорадкой Денге в Таиланде, в котором было установлено, что применение препарата один раз в сутки является безопасным, но не дает каких-либо клинических преимуществ. Однако исследователи отметили, что на основе фармакокинетических данных может быть разработан улучшенный режим дозирования15. Несмотря на то, что вирус лихордаки Денге явно существенно отличается от SARS-CoV-2, такой дизайн исследования должен дать информацию о дальнейшей работе в будущем. В целом сведения, приведенные в данном сообщении, в сочетании с изученным профилем безопасности демонстрируют, что ивермектин заслуживает дальнейшего изучения в качестве возможного противовирусного препарата для лечения инфекции, вызванной SARS-CoV-2.
Методика
Клеточная культура, вирусная инфекция и медикаментозное лечение.
Клетки линии Vero/hSLAM30 содержались в минимальной поддерживающей среде Эрла (EMEM), содержащей 7% фетальной бычьей сыворотки (FBS) (Bovogen Biologicals, Keilor East, AUS), 2 мМ L-глутамина, 1 мМ пирувата натрия, 1500 мг/л бикарбоната натрия, 15 мМ HEPES и 0,4 мг/мл генетицина при 37 ° C, 5% CO2. Клетки высевали в 12-луночные планшеты для тканевых культур за 24 ч до заражения SARS-CoV-2 (штамм Australia/ VIC01/2020) при MOI 0,1 в инфекционной среде (такая же, как поддерживающая среда, но содержащая только 2% FBS) на 2 ч. Среду, содержащую инокулят, удаляли и заменяли 1 мл свежей среды (2% FBS), содержащей ивермектин в указанных концентрациях или только ДМСО, и инкубировали, как указано, в течение 0-3 дней. В соответствующий момент времени супернатант клеток собирали и центрифугировали в течение 10 мин при 6000 g для удаления остатков клеток, и супернатант переносили в свежие пробирки для сбора. Клеточные монослои собирали соскобом и ресуспендировали в 1 мл свежей среды (2% FBS). Параллельно в каждом эксперименте проводился контроль токсичности на неинфицированных клетках.
Генерация комплементарной ДНК SARS-CoV-2
РНК экстрагировали из аликвот по 200 мкл супернатанта образца или суспензии клеток с использованием набора QIAamp 96 Virus QIAcube HT (Qiagen, Hilden, Germany) и элюировали в 60 мкл. Обратную транскрипцию проводили с использованием набора комплементарной ДНК BioLine SensiFAST (Bioline, London, United Kingdom), общей реакционной смеси (20 мкл), содержащей 10 мкл экстракта РНК, 4 мкл буфера 5x TransAmp, 1 мкл обратной транскриптазы и 5 мкл чистой воды. Реакции инкубировали при 25 ° С в течение 10 минут, 42°С в течение 15 минут и 85°С в течение 5 минут.
Обнаружение SARS-CoV-2 с использованием анализа обратной ПЦР в реальном времени TaqMan
Обратный-ПЦР-анализ TaqMan проводили с использованием 2,5 мкл кДНК, 10 мкл Primer Design PrecisonPLUS qPCR Master Mix 1 мкМ вперед (5'-AAA TTC TAT GGT GGT TGG CAC AAC ATG TT-3 '), 1 мкМ обратный (5'-TAG GCA TAG CTC TRT CAC AYT T-3 ') праймеры и 0,2 мкМ зонда (5'-FAM-TGG GTT GGG ATT ATC-MGBNFQ-3'), нацеленные на ген BetaCoV RdRp (РНК-зависимая РНК-полимераза) или Forward (5 ' -ACA GGT ACG TTA ATA GTT AAT AGC GT -3 '), обратный праймер 1 мкМ (5'-ATA TTG CAG CAG TAC GCA CAC A-3') и зонд 0,2 мкМ (5'-FAM-ACA CTA GCC ATC CTT ACT GCG CTT CG-286 NFQ-3 '), нацеленный на E-ген BetaCoV31. ОТ-ПЦР-анализ в реальном времени проводили на аппарате ПЦР в реальном времени Applied Biosystems ABI 7500 (Applied Biosystems, Фостер-Сити, Калифорния, США) с использованием условий циклирования 95° C в течение 2 минут, 95° C в течение 5 с, 60 ° С в течение 24 с. Комплементарную ДНК SARS-CoV-2 (Ct~ 28) использовали в качестве положительного контроля. Вычисленные значения Ct были преобразованы, чтобы представить в виде кратности уменьшения уровня вируса в образцах, на которые воздействовали ивермектином, по сравнению с контролем, с использованием метода ΔCt (кратное изменение в вирусной РНК = 2ˆΔCt), и они были выражены как % от образца, на который воздействовали только ДМСО. Значения IC50 подбирали, используя кривые зависимости «доза-ответ» для 3 параметров с помощью программного обеспечения GraphPad Prism.
Финансирование
Эта работа была поддержана стипендией Национального фонда борьбы с раком молочной железы (ECF-17-007) для K.M.W. и SPRF NHMRC (APP1103050) для D.A.J.
Ссылки
1 A. Gonzalez Canga, et al. The pharmacokinetics and interactions of ivermectin in humans--a mini-review AAPS J, 10 (1) (2008), pp. 42-46CrossRefView Record in ScopusGoogle Scholar
2 V. Gotz, et al. Influenza A viruses escape from MxA restriction at the expense of efficient nuclear vRNP import Sci Rep, 6 (2016), p. 23138Google Scholar
3 L. Lundberg, et al. Nuclear import and export inhibitors alter capsid protein distribution in mammalian cells and reduce Venezuelan Equine Encephalitis Virus replication. Antiviral Res, 100 (3) (2013), pp. 662-672ArticleDownload PDFView Record in ScopusGoogle Scholar
4 M.Y. Tay, et al. Nuclear localization of dengue virus (DENV) 1-4 non-structural protein 5; protection against all 4 DENV serotypes by the inhibitor Ivermectin Antiviral Res, 99 (3) (2013), pp. 301-306ArticleDownload PDFView Record in ScopusGoogle Scholar
5 K.M. Wagstaff, et al. Ivermectin is a specific inhibitor of importin alpha/beta-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus The Biochemical journal, 443 (3) (2012), pp. 851-856View Record in ScopusGoogle Scholar
6 K.M. Wagstaff, et al. An AlphaScreen(R)-based assay for high-throughput screening for specific inhibitors of nuclear import Journal of biomolecular screening, 16 (2) (2011), pp. 192-200CrossRefView Record in ScopusGoogle Scholar
7 E. Mastrangelo, et al. Ivermectin is a potent inhibitor of flavivirus replication specifically targeting NS3 helicase activity: new prospects for an old drug The Journal of antimicrobial chemotherapy (2012)Google Scholar
8 F.K. Kosyna, et al. The importin alpha/beta-specific inhibitor Ivermectin affects HIF-dependent hypoxia response pathways Biol Chem, 396 (12) (2015), pp. 1357-1367CrossRefView Record in ScopusGoogle Scholar
9 P.J. van der Watt, et al. Targeting the Nuclear Import Receptor Kpnbeta1 as an Anticancer Therapeutic Mol Cancer Ther, 15 (4) (2016), pp. 560-573CrossRefView Record in ScopusGoogle Scholar
10 S.N.Y. Yang, et al. The broad spectrum antiviral ivermectin targets the host nuclear transport importin alpha/beta1 heterodimer Antiviral Res (2020), p. 104760ArticleDownload PDFGoogle Scholar
11 L. Caly, K.M. Wagstaff, D.A. Jans Nuclear trafficking of proteins from RNA viruses: Potential target for anti-virals? Antiviral research, 95 (2012), pp. 202-206ArticleDownload PDFView Record in ScopusGoogle Scholar
12 D.A. Jans, A.J. Martin, K.M. Wagstaff Inhibitors of nuclear transport Curr Opin Cell Biol, 58 (2019), pp. 50-60ArticleDownload PDFView Record in ScopusGoogle Scholar
13 C. Lv, et al. Ivermectin inhibits DNA polymerase UL42 of pseudorabies virus entrance into the nucleus and proliferation of the virus in vitro and vivo Antiviral Res, 159 (2018), pp. 55-62ArticleDownload PDFView Record in ScopusGoogle Scholar
14 H. Ketkar, et al. Lack of efficacy of ivermectin for prevention of a lethal Zika virus infection in a murine system Diagn Microbiol Infect Dis, 95 (1) (2019), pp. 38-40ArticleDownload PDFView Record in ScopusGoogle Scholar
15 Yamasmith, E., et al., Efficacy and Safety of Ivermectin against Dengue Infection: A Phase III, Randomized, Double-blind, Placebo-controlled Trial, in he 34th Annual Meeting The Royal College of Physicians of Thailand- ‘Internal Medicine and One Health'. 2018: Chonburi, Thailand.Google Scholar
16 R.R. Rowland, et al. Intracellular localization of the severe acute respiratory syndrome coronavirus nucleocapsid protein: absence of nucleolar accumulation during infection and after expression as a recombinant protein in vero cells J Virol, 79 (17) (2005), pp. 11507-11512View Record in ScopusGoogle Scholar
17 K.A. Timani, et al. Nuclear/nucleolar localization properties of C-terminal nucleocapsid protein of SARS coronavirus Virus Res, 114 (1-2) (2005), pp. 23-34ArticleDownload PDFView Record in ScopusGoogle Scholar
18 W.N. Wulan, et al. Nucleocytoplasmic transport of nucleocapsid proteins of enveloped RNA viruses. Front Microbiol, 6 (2015), p. 553Google Scholar
19 J.A. Hiscox, et al. The coronavirus infectious bronchitis virus nucleoprotein localizes to the nucleolus J Virol, 75 (1) (2001), pp. 506-512View Record in ScopusGoogle Scholar
20 T. Wurm, et al. Localization to the nucleolus is a common feature of coronavirus nucleoproteins, and the protein may disrupt host cell division J Virol, 75 (19) (2001), pp. 9345-9356View Record in ScopusGoogle Scholar
21 M. Frieman, et al. Severe acute respiratory syndrome coronavirus ORF6 antagonizes STAT1 function by sequestering nuclear import factors on the rough endoplasmic reticulum/Golgi membrane J Virol, 81 (18) (2007), pp. 9812-9824View Record in ScopusGoogle Scholar
22 L. Dong, S. Hu, J. Gao Discovering drugs to treat coronavirus disease 2019 (COVID-19)
Drug Discov Ther, 14 (1) (2020), pp. 58-60CrossRefView Record in ScopusGoogle Scholar
23 A.A. Elfiky Anti-HCV, nucleotide inhibitors, repurposing against COVID-19 Life Sci, 248 (2020), p. 117477ArticleDownload PDFGoogle Scholar
24 C.J. Gordon, et al. The antiviral compound remdesivir potently inhibits RNA-dependent RNA polymerase from Middle East respiratory syndrome coronavirus J Biol Chem (2020)Google Scholar
25 G. Li, E. De Clercq. Therapeutic options for the 2019 novel coronavirus (2019-nCoV) Nat Rev Drug Discov, 19 (3) (2020), pp. 149-150CrossRefView Record in ScopusGoogle Scholar
26 M. Wang, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro Cell Res, 30 (3) (2020), pp. 269-271CrossRefView Record in ScopusGoogle Scholar
27 D. Buonfrate, et al. Multiple-dose versus single-dose ivermectin for Strongyloides stercoralis infection (Strong Treat 1 to 4): a multicentre, open-label, phase 3, randomised controlled superiority trial Lancet Infect Dis, 19 (11) (2019), pp. 1181-1190.ArticleDownload PDFView Record in ScopusGoogle Scholar
28 M. Navarro, et al. Safety of high-dose ivermectin: a systematic review and meta-analysis J Antimicrob Chemother, 75 (4) (2020), pp. 827-834CrossRefView Record in ScopusGoogle Scholar
29 P. Nicolas, et al. Safety of oral ivermectin during pregnancy: a systematic review and meta-analysis. Lancet Glob Health, 8 (1) (2020), pp. E92-e100ArticleDownload PDFView Record in ScopusGoogle Scholar
30 N. Ono, et al. Measles viruses on throat swabs from measles patients use signaling lymphocytic activation molecule (CDw150) but not CD46 as a cellular receptor J Virol, 75 (9) (2001), pp. 4399-4401View Record in ScopusGoogle Scholar
31 V.M. Corman, et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR
Euro Surveill, 25 (3) (2020)Google Scholar