Лечение респираторного дистресс-синдрома, вызванного COVID-19

Оригинал: Management of COVID-19 Respiratory Distress
Автор: John J. Marini, Luciano Gattinoni
Опубликовано: JAMA, 24.04.2020
Перевод: Светлана Дегтярева, Фонд профилактики рака
Острый респираторный дистресс-синдром (ОРДС) может быть вызван изменениями как со стороны просвета альвеолы, так и со стороны сосудов. Хотя входные ворота новой коронавирусной инфекции (COVID-19) — дыхательная система, и при рентгенографии или компьютерной томографии (КТ) легких обычно обнаруживается инфильтрация, респираторный дистресс-синдром включает также серьезное сосудистое повреждение, которое может требовать другого подхода к лечению, чем тот, который обычно применяется при ОРДС. Большой разброс в уровне летальности между различными отделениями интенсивной терапии указывает, что подход к вентиляционной поддержке может вносить существенный вклад в исход лечения [1, 2, 3].
COVID-19 — системное заболевание, которое первично повреждает эндотелий сосудов. При отсутствии экспертного и индивидуализированного лечения, учитывающего сосудистые изменения, у пациента с ОРДС, вызванным COVID-19 («Со-ОРДС»), может со временем развиться полиорганная недостаточность, даже если пациент не пожилого возраста и не имеет предрасполагающих сопутствующих заболеваний.
Стандартные подходы к вентиляционной поддержке при ОРДС
Как правило, для ОРДС характерны некардиогенный отек легких, гипоксемия, вызванная внутрилегочным шунтированием крови, и снижение вентилируемого объема легких («детские легкие»), что приводит к низкому комплаенсу дыхательной системы [4]. В этом случае увеличения дыхательной поверхности легких за счет расправления коллабированных отделов часто получается достичь с помощью высокого положительного давления в конце выдоха (ПДКВ), приемов расправления («рекрутирования») легких и положением пациента на животе. Поскольку высокое транспульмональное давление вызывает напряжение в легких, которое плохо переносится при ОРДС, для уменьшения вентилятор-ассоциированного легочного повреждения (VILI) используются относительно низкие дыхательные объемы совместно с «допустимой гиперкапнией». На ранних стадиях ОРДС, до истощения пациента или до начала седации, высокое транспульмональное давление совместно со спонтанными избыточными дыхательными усилиями могут приводить к повреждению легких (так называемое вызванное пациентом повреждение легких (P-SILI)) [5].
Клинические черты Со-ОРДС
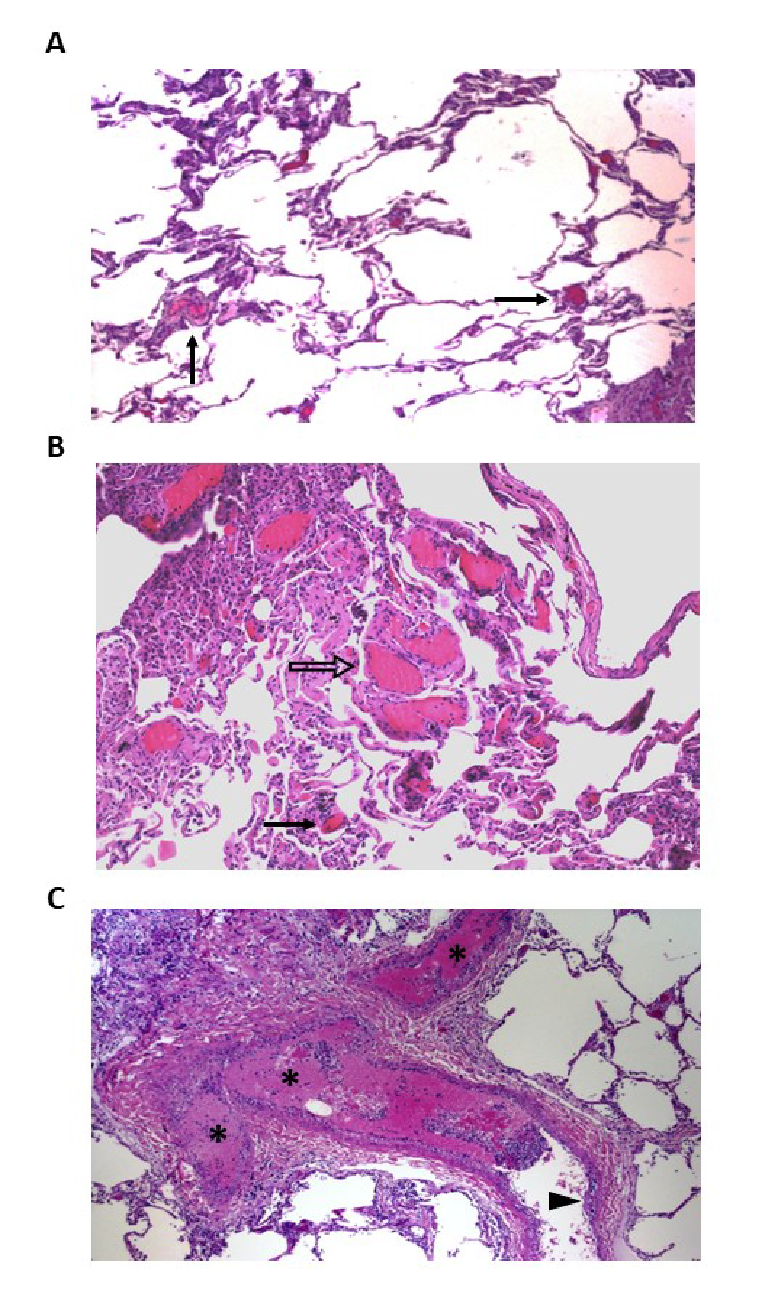
На ранних стадиях ОРДС, вызванного COVID, пациенты сохраняют относительно хороший легочный комплаенс, несмотря на крайне низкую оксигенацию. Характерна высокая минутная вентиляция. Инфильтрация часто ограничена по протяженности и в начале, как правило, характеризуется картиной матовых стекол на КТ, что указывает скорее на интерстициальный, чем на альвеолярный отек. У многих пациентов нет выраженной одышки. В упрощенной модели этих пациентов можно отнести к «типу L», для которого характерны сниженная эластичность легких (высокий комплаенс), более низкая масса легких, определяемая при КТ, и плохой ответ на ПДКВ [6]. У многих пациентов течение заболевания можно стабилизировать на данной стадии и предотвратить дальнейшее ухудшение, в то время как другие пациенты, ввиду тяжести заболевания и ответа организма или субоптимальной терапии, могут развить клиническую картину, более характерную для типичного ОРДС. Их можно отнести к «типу Н», с распространенной консолидацией по данным КТ, высокой эластичностью (низким комплаенсом), высокой массой легких и хорошим ответом на ПДКВ. Безусловно, типы L и Н — это крайние проявления спектра, который включает и промежуточные стадии, на которых характеристики этих типов могут взаимно наслаиваться. Еще одно нередко отмечаемое проявление заболевания — выраженная активация коагуляционного каскада с распространенными микро- и макро-тромбозами в легких и других органах (рис.1 в Приложении); соответственно, существенно повышенный уровень Д-димера в сыворотке стойко ассоциирован с неблагоприятными исходами [7].
Эти наблюдения указывают на фундаментальную роль диспропорционально выраженного эндотелиального повреждения, которое нарушает вазорегуляцию в легких, приводит к несоответствию вентиляции и перфузии (первичная причина гипоксии) и способствует тромбообразованию. Существенное увеличение активности дыхательного центра может дополнительно увеличивать дыхательные объемы и дыхательные усилия пациента по отношению к уязвимой ткани легких, добавляя P-SILI к комплексному воспалительному повреждению легких [5, 8]. При работе с такой мало изученной и быстро меняющейся областью только определенные аспекты принятых протективных подходов в терапии ОРДС остаются целесообразными на разных стадиях. Еще важнее, что невнимание к сосудистому компоненту (предотвращение перегрузки жидкостью, оптимизация сердечного выброса) может непреднамеренно привести к ухудшению состояния (например, отекам) и ятрогенным повреждениям.
Защита легких при Со-ОРДС
У пациентов с L-типом Со-ОРДС, имеющих хороший легочный комплаенс, возможно использование больших дыхательных объемов (7‒8 мл/кг в расчете на идеальную массу тела), чем те, которые обычно применяются при ОРДС, без увеличения риска VILI. Так, у мужчины весом 70 кг с дыхательным комплаенсом в 50 мл/см H₂O и ПДКВ в 10 см Н₂О, при дыхательных объемах 8 мл/кг давление плато достигает 21 см Н₂О, а минимальное давление вдоха — 11 см Н₂О, оба показателя значимо ниже принятых на настоящий момент порогов для протективной ИВЛ (30 и 15 см Н₂О, соответственно). Более высокие дыхательные объемы предотвращают абсорбционные ателектазы и гиперкапнию, которые могут возникнуть в результате гиповентиляции при использовании меньших дыхательных объемов.
Ключевой компонент на ранней стадии — нарушение вазорегуляции, при котором из-за эндотелиального повреждения не происходит возникающей в норме легочной вазоконстрикции в ответ на гипоксию, что приводит к несоответствию перфузии и вентиляции и может проявляться выраженной гипоксемией. Первое действие врача в такой ситуации, увеличение фракции вдыхаемого кислорода, может быть действительно эффективно на ранней стадии. Если этого недостаточно, неинвазивная поддержка (такая как высокопоточная назальная оксигенотерапия, неинвазивная вентиляция в режиме постоянного положительного давления в дыхательных путях (CPAP) или режиме двухфазного положительного давления в дыхательных путях (Bi-PAP)) могут стабилизировать течение заболевания при умеренной тяжести и при условии, что пациент не прикладывает избыточных дыхательных усилий. В то же время, если активность дыхательного центра не снижается при назначении кислорода и неинвазивной поддержке, постоянно повышенные усилия при вдохе одновременно увеличивают напряжение в тканях, повышают легочное сосудистое сопротивление, скорость потока крови и пропотевание жидкости (т.е. приводит к P-SILI) [8, 9, 10]. За этим может последовать быстрое прогрессирующее ухудшение функции легких (VILI). Ранняя интубация, эффективная седация и/или миорелаксация могут прервать этот цикл. Целесообразно стремиться к более низкому ПДКВ (8‒10 см Н₂О). Повышение среднего транспульмонального давления при помощи высокого ПДКВ или инверсии продолжительности вдоха и выдоха перенаправляет поток крови из перерастянутых открытых воздушных участков, увеличивая напряжение в высокопроницаемых микрососудах и ухудшая обмен СО₂, без существенного увеличения функциональных легочных единиц.
Если у пациента с типом L в результате течения болезни и/или из-за P-SILI прогрессирует отек легких, то объем снижается до «детских легких» и постепенно развивается повреждение по типу Н. Концентрируя вентиляционную нагрузку на уже перерастянутых «детских легких», мы увеличиваем воздействие на них и увеличиваем поток крови, таким образом, увеличивая риск прогрессирующего повреждения.
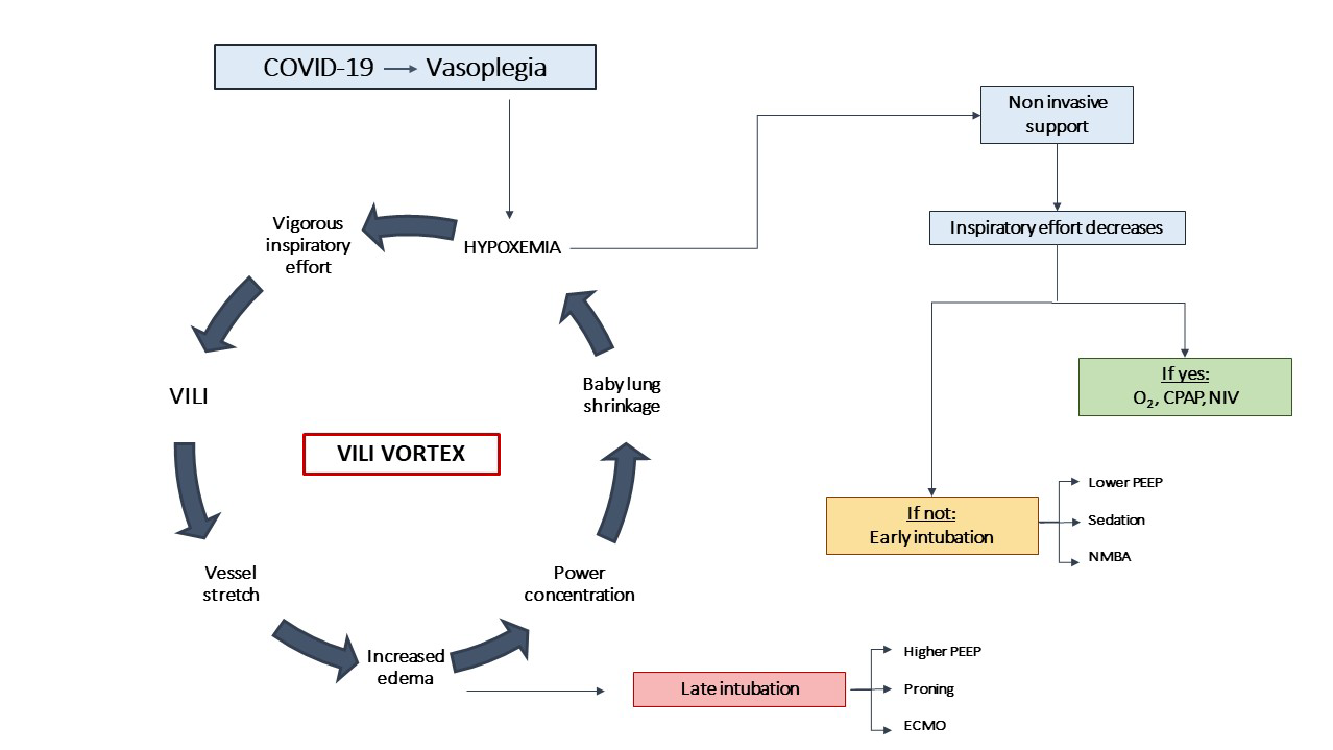
В данном патологическом каскаде вентилятор-ассоциированного повреждения «детских легких» основную роль играют два фактора: альвеолярное повреждение при вентиляции и увеличение нагрузки на сосуды, перфузирующие эти участки [9, 10] (рис. 2 в Приложении). С течением времени наложение вентилятор-ассоциированного повреждения и неконтролируемого вирусного процесса стимулируют воспаление и отек, приводя к локальному и генерализованному тромбообразованию, интенсивному высвобождению цитокинов, перегрузке правого желудочка и системной органной дисфункции. На этой продвинутой стадии болезни рекомендуется применять более традиционную протективную стратегию: более высокое ПДКВ (≤ 15 см Н₂О), сниженные дыхательные объемы (6 мл/кг) и позицию лежа на животе с одновременной минимизацией потребления кислорода. Какой бы ни был тип течения, отмена респираторной поддержки должна проводиться очень осторожно.
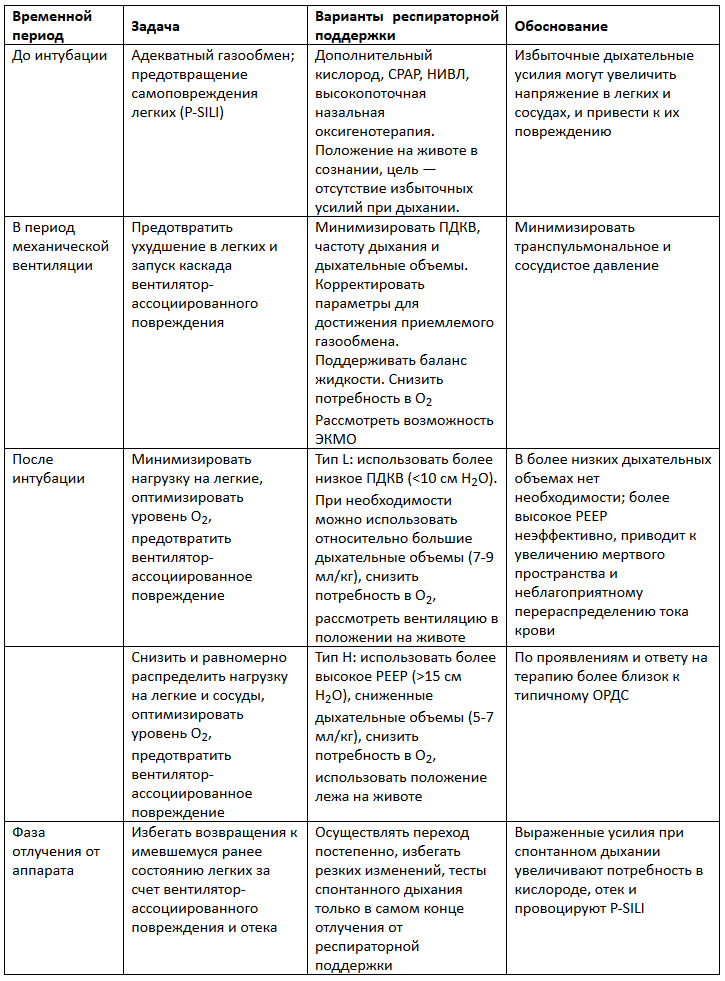
Таблица: течение заболевания и подходы к вентиляционной поддержке у пациентов с Со-ОРДС
Повреждение легких при COVID-19 уникально. Может быть целесообразно разделение пациентов на L и Н фенотипы болезни. В зависимости от патофизиологических процессов могут быть полезны различные подходы к респираторной поддержке.
Список литературы:
- Grasselli G , Zangrillo A , Zanella A , et al; COVID-19 Lombardy ICU Network. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA. 2020. Published online April 6, 2020. doi:10.1001/jama.2020.5394
- Arentz M , Yim E , Klaff L , et al. Characteristics and outcomes of 21 critically ill patients with COVID-19 in Washington State. JAMA. 2020. Published online March 19, 2020. doi:10.1001/jama.2020.4326
- Wang D , Hu B , Hu C , et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020;323(11):1061-1069. doi:10.1001/jama.2020.1585
- Gattinoni L , Marini JJ , Pesenti A , Quintel M , Mancebo J , Brochard L . The “baby lung” became an adult. Intensive Care Med. 2016;42(5):663-673. doi:10.1007/s00134-015-4200-8
- Brochard L , Slutsky A , Pesenti A . Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med. 2017;195(4):438-442. doi:10.1164/rccm.201605-1081CP
- Gattinoni L , Chiumello D , Caironi P , et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med. 2020. doi:10.1007/s00134-020-06033-2
- Zhou F , Yu T , Du R , et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-1062. doi:10.1016/S0140-6736(20)30566-3
- Marini JJ , Rocco PRM , Gattinoni L . Static and dynamic contributors to ventilator-induced lung injury in clinical practice. pressure, energy, and power. Am J Respir Crit Care Med. 2020;201(7):767-774. doi:10.1164/rccm.201908-1545CI
- Vieillard-Baron A , Matthay M , Teboul JL , et al. Experts’ opinion on management of hemodynamics in ARDS patients: focus on the effects of mechanical ventilation. Intensive Care Med. 2016;42(5):739-749. doi:10.1007/s00134-016-4326-3
- Marini JJ , Hotchkiss JR , Broccard AF . Bench-to-bedside review: microvascular and airspace linkage in ventilator-induced lung injury. Crit Care. 2003;7(6):435-444. doi:10.1186/cc2392
ПРИЛОЖЕНИЕ
Рис.1. Гистологические изменения в легких при посмертном исследовании у пациентов с COVID-19
Рис. 2. Факторы, приводящие к прогрессированию и торможению повреждения легких при COVID-19.