Коронавирусная болезнь 2019 (COVID-19): экстракорпоральная мембранная оксигенация (ЭКМО)

Оригинал: Coronavirus disease 2019 (COVID-19): Extracorporeal membrane oxygenation (ECMO)
Автор: Michael G Fitzsimons, MDJerome Crowley, MD, MPH
Опубликовано: UpToDate, 08.09.2020 (uptodate.com)
Перевод: Ирина Лагерь, Фонд профилактики рака
Введение
Пневмония, связанная с новым коронавирусным заболеванием 2019 года (COVID-19 или nCoV-2), может привести к дыхательной недостаточности с глубокой гипоксемией, требующей эндотрахеальной интубации и искусственной вентиляции легких. Пациенты, которые не реагируют на обычную искусственную вентиляцию легких, могут быть претендентами на лечение с экстракорпоральной мембранной оксигенацией (ЭКМО) в учреждениях с соответствующими ресурсами (оборудованием и персоналом).
В этой теме будут рассмотрены аспекты анестезии, хирургии и интенсивной терапии при начале и ведении ЭКМО у пациентов с дыхательной недостаточностью при COVID-19.
Общие понятия об использовании ЭКМО при прочих условиях обсуждаются в других темах (см. «Extracorporeal membrane oxygenation (ECMO) in adults» (Экстракорпоральная мембранная оксигенация у взрослых) и «Intraoperative problems after cardiopulmonary bypass», section on 'Extracorporeal membrane oxygenation' (Интраоперационные проблемы после искусственного кровообращения, раздел: Экстракорпоральная мембранная оксигенация).
Ведение вентиляции и другие вопросы интенсивной терапии у пациентов с COVID-19, у которых развивается тяжелая дыхательная недостаточность, также обсуждаются в других темах (cм. «Coronavirus disease 2019 (COVID-19): Critical care and airway management issues» (Коронавирусная болезнь 2019 года (COVID-19): вопросы интенсивной терапии и управления дыхательными путями) (and «Coronavirus disease 2019 (COVID-19): Intensive care ventilation with anesthesia machines» (Коронавирусная болезнь 2019 (COVID-19): интенсивная вентиляция легких с анестезиологическими аппаратами).
Планирование использования ЭКМО во время пандемии COVID-19
Ресурсные соображения
Учреждения без отлаженной программы ЭКМО не должны запускать новую программу во время пандемии [1-3]. ЭКМО — это ресурсоемкая терапия, для которой требуется многопрофильная команда опытных медицинских специалистов, обладающих необходимыми знаниями и опытом в инициализации, сопровождении и прекращении применения ЭКМО у пациентов в критическом состоянии [1-10]. Грамотное планирование, распределение ресурсов и инфекционный контроль необходимы для обеспечения правильного использования ЭКМО во время пандемии COVID-19. В учреждениях, которые уже близки к пределу пропускной способности из-за госпитализации большого числа пациентов, которым требуется искусственная вентиляция легких из-за COVID-19, использование ЭКМО даже в ограниченном числе случаев может привести к перегрузке учреждения [1,2,4,10].
Подготовка
Подготовка к масштабному увеличению количества пациентов во время текущей пандемии COVID-19 была сосредоточена на четырех компонентах: персонал, оборудование, учреждения и вспомогательные системы [1,11-15].
- Персонал. Наличие мультидисциплинарной команды, в состав которой входят врачи нескольких специальностей (например: хирурги, реаниматологи, анестезиологи), а также медсестры, ассистенты врачей, практикующие медсестры, респираторные терапевты и / или перфузиологи, которые ранее работали вместе, ведя пациентов ЭКМО. Критически важно, что все члены команды нуждаются в обучении по вопросам анестезиологического, хирургического и интенсивного ведения пациентов с COVID-19, включая необходимость использования соответствующих средств индивидуальной защиты (СИЗ) [1] (см. «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control» and «Coronavirus disease 2019 (COVID-19): Critical care and airway management issues» and «Coronavirus disease 2019 (COVID-19): Infection control in health care and home settings», section on 'Infection control in the health care setting' (Коронавирусное заболевание 2019 (COVID-19): проблемы с анестезией, включая обеспечение проходимости дыхательных путей и инфекционный контроль, Коронавирусное заболевание 2019 г. (COVID-19): вопросы интенсивной терапии и управления дыхательными путями, Коронавирусное заболевание 2019 г. (COVID-19): инфекционный контроль в здравоохранении и домашних условиях, раздел: инфекционный контроль в учреждениях здравоохранения).
- Оборудование. Следует определить перечень имеющихся долговременных и одноразовых расходных материалов и оборудования для начала и поддержания терапии ЭКМО с планами замены на случаи быстрого истощения запасов во время регионального пандемического всплеска числа критически больных пациентов. Такое планирование должно включать текущее обслуживание ЭТКМО и потенциальную необходимость в экстренной замене оксигенатора ЭКМО из-за проблем со свертыванием или для преобразования вено-венозной (ВВ) ЭКМО в вено-артериальную (ВА) ЭКМО (cм. «Поддержание антикоагуляции» и «Конверсия в вено-артериальный ЭКМО» ниже).акже необходимо планирование дезинфекции оборудования ЭКМО после использования. Программы, которые могут предложить ЭКМО для пациентов с COVID-19, должны также иметь возможность управлять доступностью этой поддержки по другим показаниям (например, кардиогенный шок от инфаркта миокарда, пересадка сердца, трансплантация легких, тяжелый острый респираторный дистресс-синдром (ОРДС) не от COVID-19).
- Учреждения. Размещение пациентов COVID-19 на ЭКМО-поддержке в одном отделении интенсивной терапии (ОРИТ) внутри учреждения консолидирует опыт персонала, имеющего опыт работы в ЭКМО, и снижает подверженность дополнительного медицинского персонала инфекционному риску.
- Системы поддержки. ЭКМО для пациентов с COVID-19 лучше всего предоставляется в учреждениях с соответствующим обширным опытом, который включает в себя:
- оценку надлежащего и безопасного перевода тяжелобольных пациентов из других учреждений для поддержки ЭКМО;
- управление ресурсоемким ежедневным уходом за пациентами, получающими ЭКМО (см. «Ведение ЭКМО» ниже);
- уход за пациентами с COVID-19 с тяжелой формой ОРДС.
Показания и противопоказания
Показания
Показания к ЭКМО у пациентов с острым респираторным дистресс-синдромом (ОРДС), вызванным COVID-19, аналогичны его применению в других случаях [16,17]. Мы выступаем за то, чтобы ЭКМО была зарезервирована как последнее средство после неудачи других стратегий, включая защитную вентиляцию легких, позиционирование на животе, высокое положительное давление конца выдоха (PEEP), маневры подбора (примечание: речь о давлении при ИВЛ), миорелаксанты (NMBA) и легочные вазодилататоры [1,3,4,10,18,19] (см. «Coronavirus disease 2019 (COVID-19): Critical care and airway management issues», section on 'Ventilator management of acute respiratory distress syndrome' (Коронавирусное заболевание 2019 (COVID-19): вопросы интенсивной терапии и управления дыхательными путями, раздел: искусственная вентиляция легких при остром респираторном дистресс-синдроме).
Данные относительно использования ЭКМО у пациентов с дыхательной недостаточностью из-за COVID-19 невелики [1,3,5,15,19-21]. Отчеты ретроспективных исследований предполагают вариабельное использование (в пределах от 1 до 25 процентов), что может отражать различную доступность оборудования ЭКМО и опытного персонала [21,22]. ЭКМО использовалась во время других пандемий, особенно вспышек коронавируса респираторного синдрома на Ближнем Востоке (MERS-CoV) в 2012 году и гриппа A (H1N1) в 2009 году [23-27]. Отчеты во время этих пандемий показали, что ЭКМО может улучшить оксигенацию и вентиляцию легких, а также снизить смертность у молодых инфицированных пациентов с очень тяжелой дисфункцией легких. Обсуждение фактических данных, подтверждающих использование ЭКМО у пациентов с ОРДС вследствие других различных причин, доступно в отдельной статье (см. «Extracorporeal membrane oxygenation (ECMO) in adults», section on 'Indications' (Экстракорпоральная мембранная оксигенация (ЭКМО) у взрослых, раздел: показания к применению)).
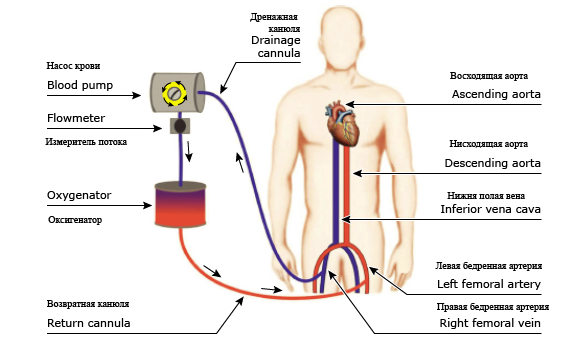
Существует два типа ЭКМО: вено-венозный (ВВ) и вено-артериальный (ВА) (рисунок 1 и рисунок 2) [6]. Пациенты с COVID-19, которые потенциально подходят для каждого типа, обсуждаются в разделах ниже [1].
Рис.1 - Вено-венозная (ВВ) ЭКМО для изолированной дыхательной недостаточности
Диаграмма венозной ЭКМО при дыхательной недостаточности. При отсутствии естественной функции легких насыщение артерий будет составлять от 75 до 85 процентов. Доступ к VV: кровь забирается из IVC, циркулирует через искусственную мембрану и возвращается через SVC в RA.
ЭКМО: экстракорпоральная мембранная оксигенация; АО: аорта; PV: легочная вена; PA: легочная артерия; LA: левое предсердие; LV: левый желудочек; РА: правое предсердие; RV: правый желудочек; CO2: углекислый газ; O2: кислород; ВВ: венозный; IVC: нижняя полая вена.
Рис. 2 - Вено-артериальная экстракорпоральная мембрана оксигенации (прим. вставлено с переводом и оригиналом)
Схема оксигенации периферической вено-артериальной экстракорпоральной мембраны. Кровь из нижней полой вены дренируется через канюлю в правой бедренной вене. Затем кровь проходит через насос крови и оксигенационную мембрану, возвращаясь в артериальную систему пациента через левую бедренную артерию.
Вено-венозная (ВВ) ЭКМО
Во время ВВ ЭКМО кровь удаляется из венозной системы, проходит через оксигенатор, а затем возвращается обратно в венозную систему, где она проходит через легкие (рисунок 1). ВВ ЭКМО является опцией при COVID-19 для подходящих взрослых с ОРДС. Пациенты невосприимчивы к обычному ведению аппаратом ИВЛ с соотношением артериального насыщения кислорода/фракции вдыхаемого кислородного напряжения (PaO2 / FiO2) < 150 при высоком FiO2 > 90 процентов и с оптимизированным PEEP (cм. «Ventilator management strategies for adults with acute respiratory distress syndrome» and «Extracorporeal membrane oxygenation (ECMO) in adults», section on 'Technique' (Стратегии ведения ИВЛ у взрослых с острым респираторным дистресс-синдромом и экстракорпоральная мембранная оксигенация (ЭКМО) у взрослых, раздел: техника)).
В некоторых случаях пациент, которому требуется ВВ ЭКМО и у которого есть дисфункция правого желудочка, может получить двухпросветный катетер ЭКМО, который фактически является чрескожным вспомогательным устройством для правого желудочка (RVAD) [28], а не инициатором ВА ЭКМО (cм. «Методы сосудистой канюляции» ниже и «Вено-артериальный (ВА) ЭКМО» ниже).
Вено-артериальная (ВА) ЭКМО
Во время ВА ЭКМО кровь удаляется из венозной системы и возвращается в артериальную систему (рисунок 2), обеспечивая тем самым как сердечную, так и легочную поддержку [29]. Использование ВА ЭКМО предназначено для некоторых пациентов с COVID-19 с тяжелой дыхательной недостаточностью, сопровождающейся тяжелой сердечной недостаточностью, дисфункцией правого желудочка (ПЖ), чрезмерным шунтированием через легкие (например, из-за легочной эмболии), персистирующими злокачественными аритмиями, острым инфарктом миокарда или острым миокардитом [1,17] (cм. «Coronavirus disease 2019 (COVID-19): Myocardial injury» и «Coronavirus disease 2019 (COVID-19): Myocardial infarction and other coronary artery disease issues» и «Coronavirus disease 2019 (COVID-19): Hypercoagulability» и «Extracorporeal membrane oxygenation (ECMO) in adults», section on 'Technique' (Коронавирусное заболевание 2019 (COVID-19): повреждение миокарда и Коронавирусное заболевание 2019 (COVID-19): инфаркт миокарда и другие проблемы ишемической болезни сердца и Коронавирусное заболевание 2019 (COVID-19): гиперкоагуляция и экстракорпоральная мембранная оксигенация (ЭКМО) у взрослых, раздел: техника)).
Противопоказания
ЭКМО у пациентов с COVID-19 противопоказана пациентам с тяжелыми сопутствующими заболеваниями, несовместимыми с выздоровлением [1]. Примеры включают полиорганную недостаточность, прогрессирующую злокачественную опухоль, тяжелую неврологическую травму, остановку сердца в течение длительного периода или недавнее или расширяющееся кровоизлияние в центральную нервную систему.
Относительные противопоказания для пациентов с COVID-19, особенно в центрах со значительными ограниченными ресурсами, могут включать [1, 3, 10, 14, 15, 30]:
- пожилой возраст (особенно, если присутствуют другие сопутствующие заболевания; обычно возраст > 70 лет, хотя возраст может варьироваться в зависимости от прогнозируемой обратимости основной патофизиологии);
- морбидное ожирение, определяемое как индекс массы тела > 40 кг / м²;
- тяжелое состояние с иммунодефицитом;
- прогрессирующая хроническая систолическая сердечная недостаточность;
- экстракорпоральная сердечно-легочная реанимация после остановки сердца, которая не проходит быстро при стандартном расширенном сердечном жизнеобеспечении (см. «Therapies of uncertain benefit in basic and advanced cardiac life support», section on 'Extracorporeal oxygenation' (Терапия неопределенной пользы в базовом и продвинутом сердечном жизнеобеспечении, раздел: экстракорпоральная оксигенация) [31].
Острая почечная недостаточность не является противопоказанием к ЭКМО [3]. На самом деле многие пациенты с COVID-19 имеют острую почечную недостаточность когда начинается ЭКМО, и могут нуждаться в постоянной заместительной почечной терапии во время поддержки ЭКМО. В идеале ЭКМО может быть начата для пациента с COVID-19, когда продолжительность искусственной вентиляции легких составляет менее семи-десяти дней, хотя четкого отсечения нет [3,14].
Пациенты с незначительными или отсутствующими сопутствующими заболеваниями получают приоритет при ограниченных ресурсах [1,3]. Когда во время пандемии возможности больничной системы перегружены, ограниченность институциональных или региональных ресурсов может быть препятствием к использованию ЭКМО [1] (см. «Ресурсные соображения» вышe).
Инициация ЭКМО
Меры предосторожности при канюляции сосудов
Для пациентов с новым COVID-19 канюли для ЭКМО по возможности размещают у кровати в отделении интенсивной терапии (ОРИТ), тем самым избегая необходимости транспортировки пациента в процедурный комплекс с оборудованием для флюороскопии [1]; это отличается от типичного лечения для пациентов без COVID-19. Избегание транспортировки пациентов для размещения катетера сводит к минимуму количество медицинского персонала, подвергающегося риску заражения, и избегает отключения от аппарата интенсивной терапии, что может привести к альвеолярной деструкции и сердечно-легочной нестабильности [32]. Хотя использование комнаты с отрицательным давлением идеально подходит для любой инвазивной процедуры, выполняемой у пациента с COVID-19, это может оказаться невозможным, если необходимо перемещение пациента (cм. «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'Infection control during patient transport' (Коронавирусное заболевание 2019 (COVID-19): проблемы анестезии, включая управление дыхательными путями и инфекционный контроль, раздел: инфекционный контроль во время транспортировки пациента).
Дыхательные пути должны быть защищены эндотрахеальной интубацией перед канюляцией сосудов для ЭКМО [1]. Центры по контролю и профилактике заболеваний (CDC) и другие организации заявляют, что хирурги, анестезиологи и другие участвующие специалисты в канюляции и инициации ЭКМО должны в идеале носить средства индивидуальной защиты (СИЗ), оптимальные для обеспечения безопасности при контактном, воздушно-капельном контакте (включая респираторы стандарта N95 или выше, или респираторы с очисткой воздуха [PAPR]) [15]. Однако, если респираторы N95 и PAPR отсутствуют, а дыхательные пути пациента защищены, то использование хирургической маски является приемлемой альтернативой (см. «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'Hand hygiene and personal protective equipment' и «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'PPE for care of patients who undergo low risk procedures' (Коронавирусное заболевание 2019 (COVID-19): анестезиологические проблемы, включая управление дыхательными путями и инфекционный контроль, раздел: гигиена рук и средства индивидуальной защиты и Коронавирусное заболевание 2019 (COVID-19): анестезиологические проблемы, включая управление дыхательными путями и инфекционный контроль, раздел: СИЗ для ухода за пациентами, проходящими процедуры низкого риска)).
Примечательно, что введение канюли ЭКМО может быть проблематичным у пациентов с COVID-19, у которых развивается быстрое ухудшение состояния [33]. В учреждении неотложной помощи ЭКМО требуются две отдельные команды, одна из которых управляет внезапными клиническими изменениями, в то время как другая команда выполняет канюляцию сосудов и создает ЭКМО.
Методы канюлизации сосудов
Существует три типа стратегий канюлизации, которые могут использоваться для вено-венозной (ВВ) ЭКМО (перечислены в порядке предпочтения) для пациентов с COVID-19 (таблица 1 и таблица 2):
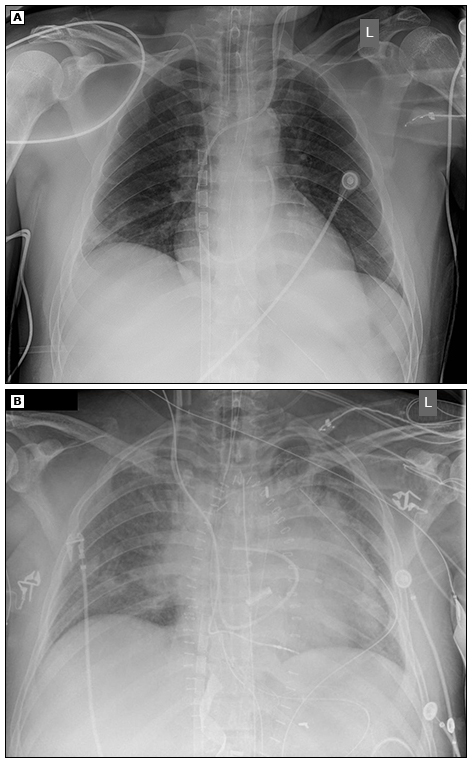
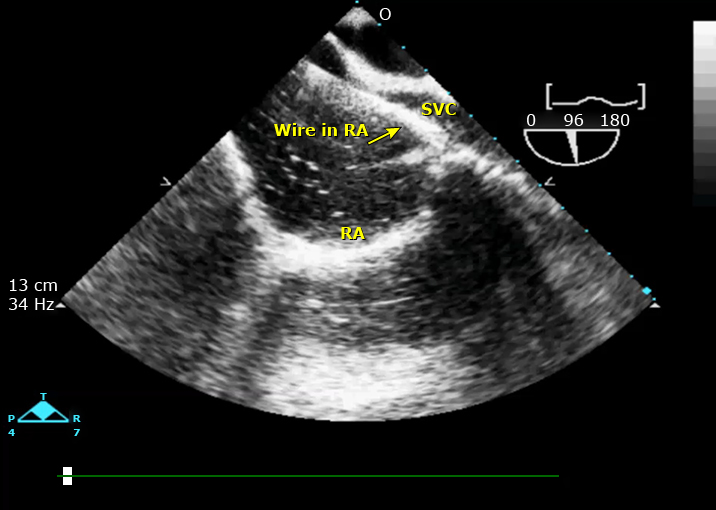
- Предпочтительный подход к ВВ ЭКМО у пациентов с COVID-19 включает дренаж из приточной канюли бедренной вены, которая помещается в проксимальную нижнюю полую вену, с возвратом оксигенированной крови через канюлю оттока, вставленную во внутреннюю яремную вену (IJ, предпочтительно правый), и располагается рядом с верхним каватриальным соединением (изображение 1) [13, 15, 17]. В идеале эти канюли могут обеспечивать кровоток до 7 л / мин [34].Канюли могут быть размещены с помощью чрескожной или открытой техники. Подтверждение положения выполняется с помощью рентгенографии грудной клетки (CXR) (изображение 2). В то время как трансторакальная эхокардиография или чреспищеводная эхокардиография (ЧПЭхоКГ) могут использоваться для обеспечения оптимального размещения канюль (изображение 3), обследование ЧПЭхоКГ, по возможности, следует избегать для пациентов с COVID-19, поскольку это процедура, генерирующая аэрозоль, хотя риск снижается после эндотрахеальной интубации [35-40].
Изображение 2 — Позиционирование венозной возвратной канюли для ЭКМО
Изображение 3 — Чреспищеводная эхокардиография (ЧПЭхоКГ)— ориентированное размещение проволоки для канюлизации экстракорпоральной мембранной оксигенации (ЭКМО)
- Другим подходом для установки ВВ ЭКМО является введение двухпортового катетера с одним просветом [41]. Катетер с одним просветом может быть введен чрескожно через вену IJ, при этом дренажные отверстия располагаются в верхней и нижней полых венах [42]. Кровь забирается из этих дренажных отверстий, проходит через оксигенатор, а затем возвращается через единственный канал, расположенный рядом с трехстворчатым клапаном. Такие катетеры обеспечивают подвижность пациента в отделении интенсивной терапии (например, сидя в интубации).
Хотя первоначальное размещение двухпортовой канюли обычно выполняется с помощью флюороскопии, размещение и последующее изменение положения могут быть выполнены с использованием только чреспищеводной эхокардиографии (ЧПЭхоКГ) [43-47]. Однако установка канюли с помощью чреспищеводной эхокардиографии (ЧПЭхоКГ) не идеальна для пациента с COVID-19, потому что процедура отнимает много времени и могут потребоваться частые корректировки, что подвергает эхокардиографа риску заражения. При попытке размещения с чреспищеводной эхокардиографией (ЧПЭхоКГ) необходимы меры индивидуальной защиты и воздушно-капельные меры предосторожности, соответствующие процедурам высокого риска [36-38] (см. «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'PPE for care of patients who undergo aerosol-generating procedures' (Коронавирусное заболевание 2019 (COVID-19): проблемы анестезии, включая управление дыхательными путями и инфекционный контроль, раздел: СИЗ для ухода за пациентами, проходящими процедуры, генерирующие аэрозоль)). - Один доступный в продаже катетер с двумя просветами на самом деле представляет собой чрескожное вспомогательное устройство для правого желудочка (RVAD), которое можно использовать с оксигенатором для обеспечения поддержки ЭКМО [15, 28, 48]. Эта канюля вводится через правую вену под флюороскопией. Кровь отводится из правого предсердия, проходит через оксигенатор, а затем возвращается к пациенту сразу после клапана в легочной артерии [28]. Поскольку для позиционирования этой канюли с двумя просветами необходимо использовать рентгеноскопию, требуется транспортировка пациента в рентгеноскопическое отделение или в гибридную операционную, что влечет за собой дополнительные риски и необходимые меры инфекционного контроля (см. «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'Infection control during patient transport' (Коронавирусное заболевание 2019 (COVID-19): проблемы анестезии, включая управление дыхательными путями и инфекционный контроль, раздел: Инфекционный контроль во время транспортировки пациента)).
Ведение ЭКМО
Ведение вено-венозной ЭКМО
Цели поддержания оксигенации и вентиляции во время вено-венозной (ВВ) ЭКМО одинаковы для пациентов с дыхательной недостаточностью, вызванной новым COVID-19 и для пациентов без COVID-19.
В отсутствие какого-либо значительного газообмена в легких, который может происходить при тяжелом остром респираторном дистресс-синдроме (ОРДС), поток ВВ ЭКМО должен составлять не менее 60-70 % сердечного выброса, чтобы обеспечить адекватное насыщение артериальной крови оксигемоглобином (то есть > 88 %). Это может быть лучше всего достигнуто путем:
- Поддержания адекватного потока ЭКМО, аналогичного нормальному сердечному выбросу (то есть. от 4 до 8 л/мин). Если поток ЭКМО ограничен дренажом, рассмотрите возможность добавления второй дренажной канюли бедренной кости. Если у пациента проявляется гипердинамическая функция сердца, инфузия эсмолола может быть целесообразной для снижения нативного сердечного выброса. Однако эта стратегия может оказаться невозможной у пациентов с дистрибутивным шоком (например, из-за сепсиса).
- Обеспечения минимизации рециркуляции. В хорошо функционирующем контуре ВВ ЭКМО дезоксигенированная кровь отводится от пациента (обычно в нижней полой вене), проходит через оксигенатор для газообмена, возвращается в верхнюю полую вену, а затем системно перекачивается сердцем. Если происходит нежелательная рециркуляция, часть насыщенной кислородом крови отводится обратно в контур ЭКМО, а не перекачивается системно (так что кровь фактически перемещается непосредственно из возвратной канюли в дренажную канюлю). В этом случае увеличение потока насоса ЭКМО будет иметь минимальное влияние на системную оксигенацию [49]. Если подозревается рециркуляция, положение канюль следует проверить с помощью рентгенограммы; корректировки могут быть необходимы. Цель состоит в том, чтобы сохранить расстояние между канюлями не менее 8 см [50].
- Поддержания оксигенации. Если ЭКМО не подходит для оксигенации, то усилия по обеспечению оптимального вклада нативного легкого обычно включают корректировку параметров искусственной вентиляции легких, хотя это может привести к повреждению легкого. Другие вмешательства, такие как ингаляционные легочные вазодилататоры или позиционирование на животе, также могут применяться у отдельных пациентов (см. «Ventilator management strategies for adults with acute respiratory distress syndrome», section on 'Refractory patients' (Стратегии ведения ИВЛ у взрослых с острым респираторным дистресс-синдромом, раздел: Рефрактерные пациенты).
Следующие дополнительные проблемы характерны для пациентов с COVID-19 [1]:
- Пациентам с COVID-19 может потребоваться больше седативного эффекта, чем некоторым другим тяжелобольным пациентам [51-53]. Более высокие седативные требования у пациентов с COVID-19 могут быть связаны с их более молодым возрастом, более высоким дыхательным движением, увеличенной скоростью очищения крови, вызванной другими лекарствами, и особенно интенсивной воспалительной реакцией [51,53]. Как и у других пациентов с ОРДС на механической вентиляции, седативные средства должны подбираться в соответствии с индивидуальными потребностями пациента. Тем не менее, может быть особенно трудно отличить седативный эффект от умеренного до серьезного во время поддержки ЭКМО пациента с COVID-19 из-за развития сильного возбуждения, которое может привести к смещению канюли ЭКМО, сдвигу венозного возврата, влияющему на потоки ЭКМО, или диссинхронии вентилятора [51,52] (см. «Coronavirus disease 2019 (COVID-19): Critical care and airway management issues», section on 'Sedation and analgesia' (Коронавирусное заболевание 2019 (COVID-19): вопросы интенсивной терапии и управления дыхательными путями, раздел: седация и анальгезия).
- Трахеостомию часто рассматривают после начала ЭКМО у пациентов без COVID-19 с дыхательной недостаточностью, чтобы улучшить комфорт пациента и и облегчить седацию. Тем не менее, трахеостомия может быть разумно отсрочена у пациентов с COVID-19, так как это процедура, генерирующая аэрозоль, и потребность в седации может быть высокой даже после трахеостомии [1,51,54].Надлежащее использование средств индивидуальной защиты (СИЗ) является критически важным во время трахеостомии у пациента с COVID-19 [54,55] (см. «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'PPE for care of patients who undergo aerosol-generating procedures' (Коронавирусное заболевание 2019 (COVID-19): проблемы анестезии, включая управление дыхательными путями и инфекционный контроль, раздел: СИЗ для ухода за пациентами, проходящими процедуры, генерирующие аэрозоль). В идеале трахеостомия выполняется в отделении интенсивной терапии (ОРИТ), а не в операционной, что исключает транспортировку пациента в другое место в больнице. Открытый, а не чрескожный подход уменьшает потребность в манипуляциях с дыхательными путями и бронхоскопии; однако при открытой трахее необходимо уделять пристальное внимание предотвращению вентиляции легких [54,55]. Мышечные релаксанты используются для снижения риска кашля (см. «Coronavirus disease 2019 (COVID-19): Critical care and airway management issues», section on 'Tracheostomy' Коронавирусное заболевание 2019 года (COVID-19): вопросы интенсивной терапии и управления дыхательными путями, раздел: трахеостомия).
- Известно, что легкая вентиляция пациентов с COVID-19 с дыхательной недостаточностью является преимуществом в период искусственной вентиляции легких до начала ЭКМО. Хотя позиционирование на животе обычно не предпринимается во время поддержки ЭКМО из-за риска смещения канюли, оно может использоваться у отдельных пациентов, особенно если отлучение от ЭКМО необходимо из-за кровотечения или инфекции места канюлирования (см. «Coronavirus disease 2019 (COVID-19): Critical care and airway management issues», section on 'Prone ventilation' (Коронавирусное заболевание 2019 года (COVID-19): вопросы интенсивной терапии и управления дыхательными путями, раздел: склонная вентиляция легких).
Конверсия в вено-артериальную ЭКМО
Хотя и относительно редко, конверсия ВВ ЭКМО в вено-артериальную (ВА) ЭКМО может быть целесообразной для отдельных пациентов с COVID-19 [1, 15]. Развитие сердечно-легочной недостаточности с недостаточной перфузией тканей или шоковым проявлением гипотонии и низким сердечным выбросом может наблюдаться у некоторых пациентов на ВВ ЭКМО поддержке, несмотря на достаточный внутрисосудистый объем и использование стандартных и новых вазопрессоров для лечения вазоплегии [56]. Это может быть связано с дисфункцией правого желудочка вследствие тяжелого ОРДС или тромбоэмболии легочной артерии [57-59], постоянными злокачественными аритмиями или кардиогенным шоком из-за острого инфаркта миокарда или миокардита [29,60].
При ВА ЭКМО обычно используют бедренно-бедренную конфигурацию (дренаж из бедренной вены возвращается в бедренную артерию) [1]. Из-за большого размера артериальной канюли, которая вводится чрескожно в бедренную артерию при инициации ВА ЭКМО, часто случаются осложнения ишемии нижних конечностей [29]. Профилактическое ипсилатеральное введение дистального перфузионного катетера антеградно в поверхностную бедренную артерию и бдительный мониторинг ишемии нижних конечностей (например, с помощью спектроскопии в ближней инфракрасной области для мониторинга тканей на икрах) применяются в качестве стратегий для снижение риска осложнений ишемии конечностей [61].
Достаточность антикоагуляции еще более критична при ВА ЭКМО по сравнению с терапией ВВ ЭКМО, поскольку артериальные или внутрисердечные тромбоэмболические явления имеют тяжелые последствия [29, 62] (см. «Поддержание антикоагуляции» ниже).
Поддержание антикоагуляции
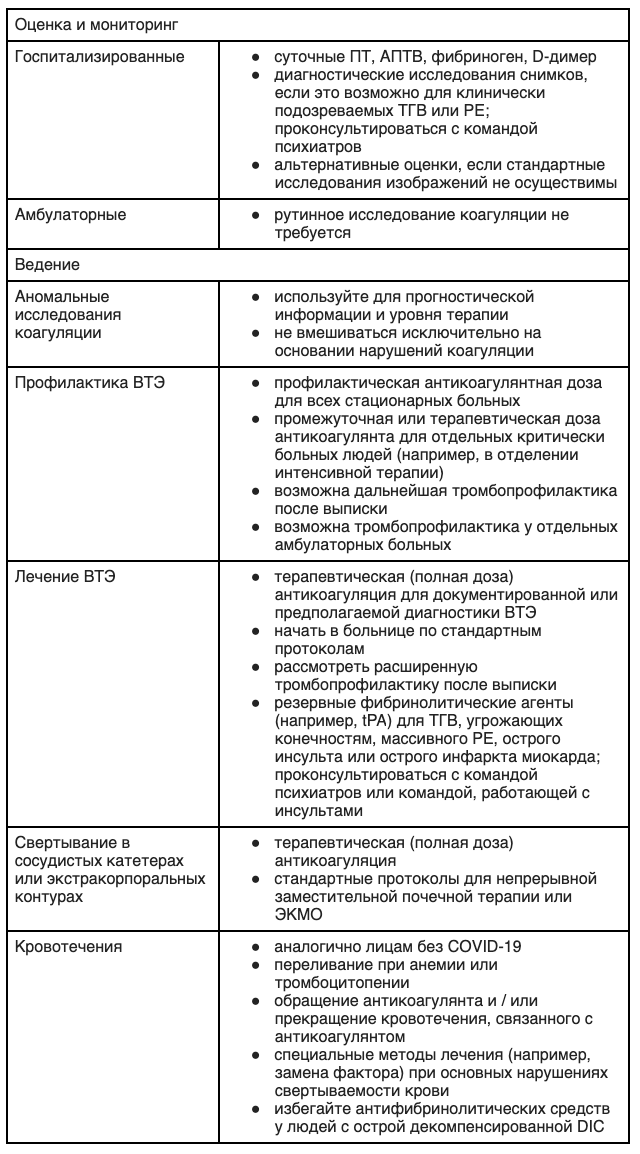
Гиперкоагуляция часто встречается у пациентов с COVID-19 (см. «Coronavirus disease 2019 (COVID-19): Hypercoagulability», section on 'Routine testing (all patients)' (Коронавирусное заболевание 2019 (COVID-19): гиперкоагуляция, раздел: рутинное тестирование (все пациенты)[1,63]. Бдительный мониторинг необходим для выявления развития диссеминированного внутрисосудистого свертывания (ДВС) и / или тромбоза в схемах циркуляции ЭКМО или других местах, таких как легочные артерии, нижняя полая вена или в правом желудочке [1, 15, 58, 59, 63-70]. Суточные уровни протромбина (PT), частичного тромбопластинового времени (PTT), фибриногена и D-димера получают для мониторинга признаков гиперкоагуляции или DIC (таблица 1).
Таблица 1 — Краткий справочник по оценке и лечению гиперкоагуляции, связанной с COVID-19
Таким образом, пристальное внимание необходимо для обеспечения адекватной непрерывной антикоагуляции для поддержания циркуляции ЭКМО [1]. Мониторинг антикоагуляции во время ЭКМО терапии является сложной задачей даже у пациентов без COVID-19. Большинство учреждений нацелены на активированное частичное тромбопластиновое время (aPTT), которое по меньшей мере в 1,5 раза превышает значение институционального контроля, хотя часто используются более высокие целевые показатели (например, от 2,0 до 2,5 от значения институционального контроля) [71]. В некоторых учреждениях применяется непрерывная внутривенная инфузия гепарина. Многие центры также используют активированное время свертывания (ACT) для руководства антикоагуляцией. Однако ACT плохо коррелирует с АПТВ [6, 72]. Тромбоэластография (ТЭГ) или адаптация ТЭГ, известная как ротационная тромбоэластометрия (ROTEM), также использовалась для направления антикоагуляции [73, 74].
Некоторые центры проводят ежедневную трансторакальную эхокардиографию у пациентов с COVID-19 на ВВ ЭКМО для мониторинга ранних признаков острого легочного сердца из-за РЕ (эмболии легочной артерии) [5,57]. Образование тромбов в оксигенаторе или контуре с признаками гипоксемии, не обусловленной другими причинами (например, шунтирование через легкие), требует обмена оксигенатора. Внутрисердечное образование сгустков во время ЭКМО встречается редко, смертность в этом случае высока; лечение может включать полную системную антикоагуляцию или хирургическую эмболэктомию [62] (cм. «Extracorporeal membrane oxygenation (ECMO) in adults», section on 'Thromboembolism' (Экстракорпоральная мембранная оксигенация (ЭКМО) у взрослых, раздел: тромбоэмболия) и «Coronavirus disease 2019 (COVID-19): Hypercoagulability», section on 'Clotting of intravascular access devices' (Коронавирусное заболевание 2019 (COVID-19): гиперкоагуляция, раздел: свертывание крови внутрисосудистыми устройствами доступа)).
Отлучение от ЭКМО
Улучшение податливости легких и насыщения артериальной крови оксигемоглобином указывает на то, что пациент может быть готов к отлучению от ЭКМО [1, 6]. Как правило, используются институциональные протоколы отлучения (алгоритм 1) [1,5].
У пациентов с другими типами ОРДС средняя продолжительность ЭКМО может составлять 10 дней, а общая продолжительность пребывания в отделении интенсивной терапии составляет приблизительно один месяц. Однако, ранние данные для пациентов с COVID-19 указывают на то, что может потребоваться значительно более длительный период поддержки ЭКМО. Исходя из данных одного из исследований, в среднем ЭКМО используются 29 дней [48], а в некоторых исследованиях сообщалось об использовании ЭКМО в течение трех-шести недель [3, 5, 19].
Непрерывная оценка риска: необходима оценка эффективности терапии ЭКМО [1,3]. Хотя определения бесполезности специфичны для конкретного учреждения, некоторые центры рассматривают возможность возвращения к традиционному лечению, если после 21 дня не наблюдается восстановления легких или сердечной деятельности.
Осложнения при ЭКМО
Осложнения введения канюли для ЭКМО включают кровотечение, неврологическое повреждение (от гипоксемии или тромбоза), тромбоцитопению (вызванную гепарином или другими препаратами) и сосудистые осложнения, связанные с канюлей. Эти осложнения обсуждаются отдельно (см. «Extracorporeal membrane oxygenation (ECMO) in adults», section on 'Complications' (Экстракорпоральная мембранная оксигенация (ЭКМО) у взрослых, раздел: осложнения)).
Вероятность смертности среди взрослых пациентов, получающих поддержку ЭКМО при других диагнозах, составляет от 33 до 92 процентов [75]. Ранние сообщения из Китая и Европы о использовании ЭКМО у пациентов с COVID-19, отмечали более высокий уровень смертности, превышающий в ряде случаев 80 процентов [9,76]. Однако, результаты стали обнадеживающими, поскольку удалось получить больше опыта в вопросах использования ЭКМО: смертность составила от 15 до 57 процентов [3,5,13,20,48,77]. Примечательно, что некоторые из этих оценок учитывали пациентов, все еще использующих ЭКМО и/или получающих интенсивную терапию на момент публикации результатов.
После успешного отлучения от ЭКМО обычно требуется дополнительное время на интенсивную терапию для пациентов с COVID-19, чтобы достичь частичного выздоровления от тяжелого делирия, который может возникнуть после длительных периодов седации, необходимых для искусственной вентиляции легких и поддержки ЭКМО, и / или глубокой слабости после использования миорелаксантов (NMBA) для облегчения искусственной вентиляции легких [48, 51, 78].
Долгосрочные осложнения возникают у выживших пациентов после острого респираторного дистресс-синдрома (ОРДС), вызванного с тяжелой формой COVID-19, и после использования ЭКМО. Низкое качество жизни, связанное со здоровьем, возникает из-за физических ограничений, психических симптомов (например, тревоги, депрессии, посттравматического стрессового расстройства) и хронической боли, как и у других пациентов, проходящих длительную интенсивную терапию с использованием обычной искусственной вентиляцией легких [79-82].
Ссылки на руководства сообщества
Ссылки на общественные и правительственные руководства из отдельных стран и регионов мира предоставляются отдельно (см. «Society guideline links: Coronavirus disease 2019 (COVID-19) – International and government guidelines for general care» и «Society guideline links: Coronavirus disease 2019 (COVID-19) – Guidelines for specialty care» и «Society guideline links: Coronavirus disease 2019 (COVID-19) – Resources for patients» (Общество-ориентированные ссылки: коронавирусное заболевание 2019 (COVID-19) — международные и правительственные руководящие принципы для общего ухода и Общество-ориентированные ссылки: коронавирусное заболевание 2019 (COVID-19) — принципы специализированной помощи и Общество-ориентированные ссылки: коронавирусное заболевание 2019 (COVID-19) — ресурсы для пациентов).
Информация для пациентов
UpToDate (Насущное) предлагает два типа учебных материалов для пациентов: «The Basics» (Основы) и «Beyond the Basics» (Основы плюс). Пособие для пациентов «The Basics» (Основы) написано простым языком уровня чтения с 5-го по 6-й класс. В нем описаны ответы на 4-5 основных вопросов, которые могут возникнуть у пациентов. Данные статьи подойдут для тех пациентов, которые хотят получить общее представление о болезни. Пособие включает в себя небольшие и легко читаемые материалы. Пособие «Beyond the Basics» (Основы плюс) включает в себя сложнее и детальное описание картины болезни. Сложность уровня чтения: 10-12 класс. Данное пособие подойдет для пациентов, которые хотят получить подробную информацию о болезни и хорошо владеют медицинской терминологией.
Здесь Вы можете найти пособия для пациентов по теме. Рекомендуем Вам распечатать данные статьи или отправить их пациентам по электронной почте. (Вы также можете найти статьи по другим темам для пациентов отправив запрос «информация для пациентов» через окно поиска или отправив запрос по ключевым словам).
Основные темы (см. «Patient education: Coronavirus disease 2019 (COVID-19) overview (The Basics)» (Обучение пациентов: коронавирусное заболевание 2019 (COVID-19) обзор (Основы).
Заключение и рекомендации
- Экстракорпоральная мембранная оксигенация (ЭКМО) — это ресурсоемкая терапия, требующая участия многопрофильной команды опытных медицинских специалистов, обладающих необходимыми знаниями и опытом для начала, поддержания и прекращения ЭКМО у пациентов в критическом состоянии. Подготовка к географическим региональным наплывам пациентов с новой тяжелой коронавирусной болезнью 2019 года (COVID-19 или nCoV) была сосредоточена на четырех компонентах: персонал, оборудование, средства и системы поддержки (см. «Подготовка» выше).
- Учреждения без устоявшейся программы ЭКМО не должны пытаться инициировать новую программу, когда во время пандемии не хватает ресурсов. Даже учреждения, имеющие опыт лечения ЭКМО, могут достичь предела мощности, если большое количество госпитализированных пациентов с COVID-19 нуждается в искусственной вентиляции легких, так что использование ЭКМО даже в ограниченном числе случаев может привести к перегрузке ресурсов больницы (см. «Ресурсные соображения» выше).
- Показания к ЭКМО у пациентов с острым респираторным дистресс-синдромом (ОРДС) вследствие COVID-19 аналогичны показаниям для других причин ОРДС. Тем не менее, данные относительно использования у пациентов с COVID-19 скудны. Мы выступаем за то, чтобы ЭКМО был зарезервирован в качестве последнего средства после неудачной стратегии искусственной вентиляции легких (включая позиционирование на животе, высокое положительное давление в конце выдоха [PEEP], маневры подбора, миорелаксанты [NMBAs] и легочные вазодилататоры) (см. «Показания» выше и «Extracorporeal membrane oxygenation (ECMO) in adults», section on 'Indications' (Экстракорпоральная мембранная оксигенация (ЭКМО) у взрослых, раздел: показания к применению)).
- Существует два типа ЭКМО, вено-венозная (ВВ) и вено-артериальная (ВА) (рисунок 1 и рисунок 2). ВВ ЭКМО обычно выбирается для лечения тяжелых ОРЗ, устойчивых к оптимальному лечению ИВЛ и адъювантной стратегии. ВА ЭКМО для пациентов с COVID-19 с дыхательной недостаточностью обычно предназначена для пациентов с дисфункцией правого желудочка вследствие тяжелой ОРДС или тромбоэмболии легочной артерии, персистирующих злокачественных аритмий или кардиогенного шока вследствие острого инфаркта миокарда или острого миокардита (см. «Вено-венозная (ВВ) ЭКМО», «Вено-артериальная (ВА) ЭКМО» и «Конверсия в вено-артериальную ЭКМО» выше).
- Абсолютные противопоказания к применению ЭКМО у пациентов с COVID-19 включают наличие тяжелых сопутствующих заболеваний, несовместимых с выздоровлением (например, полиорганная недостаточность, прогрессирующее злокачественное новообразование, тяжелое неврологическое повреждение, остановка сердца в течение длительного периода). Относительные противопоказания для пациентов с COVID-19, особенно в центрах со значительно ограниченными ресурсами, могут включать пожилой возраст, ожирение с индексом массы тела > 40 кг/м², тяжелый статус с иммунодефицитом или хроническую сердечную недостаточность. Острая почечная недостаточность не является противопоказанием (см. «Противопоказания» выше и «Extracorporeal membrane oxygenation (ECMO) in adults», section on 'Relative contraindications' (Экстракорпоральная мембранная оксигенация (ЭКМО) у взрослых, раздел: относительные противопоказания)).
- Сосудистая канюлизация и начало ЭКМО выполняются у постели больного в отделении интенсивной терапии (ОРИТ), когда это возможно, что позволяет избежать необходимости транспортировки пациента в процедурный комплекс с рентгеноскопическим оборудованием. Дыхательные пути уже должны быть защищены эндотрахеальной интубацией. Участвующие хирурги, анестезиологи и другие клиницисты должны носить средства индивидуальной защиты (СИЗ), оптимальные для обеспечения безопасности при контакте, каплях и в воздухе (см. 'Precautions for vascular cannulation' (Меры предосторожности при канюлировании сосудов) above and «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'Hand hygiene and personal protective equipment' (Коронавирусное заболевание 2019 (COVID-19): проблемы анестезии, включая управление дыхательными путями и инфекционный контроль, раздел: гигиена рук и средства индивидуальной защиты. «Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control», section on 'PPE for care of patients who undergo low risk procedures' (Коронавирусное заболевание 2019 (COVID-19): проблемы анестезии, включая управление дыхательными путями и инфекционный контроль, раздел: СИЗ для ухода за пациентами, проходящими процедуры низкого риска)).
- Предпочтительный подход для ВВ ЭКМО включает дренаж из канюли притока бедренной вены, которая пронизана в правое предсердие, с возвратом оксигенированной крови через отводящую канюлю, вставленную во внутреннюю яремную вену и расположенную рядом с верхним кавоатриальным соединением (изображение 1) (категория 2С). Использование одного катетера с двумя просветами является другим вариантом. Этот подход позволяет избежать необходимости введения катетера с помощью флюороскопии (которая включает транспортировку пациента в пределах больницы) или чреспищеводной эхокардиографии (которая является процедурой, генерирующей аэрозоль). (см. «Методы канюляции сосудов» выше).
- Цели по поддержанию оксигенации и вентиляции во время ЭКМО одинаковы для пациентов с COVID-19 и без со следующими заметными проблемами (см. «Ведение вено-венозной ЭКМО» выше):
- Отлучение от умеренных до тяжелых уровней седации может быть затруднено из-за сильного возбуждения, которое может привести к смещению канюль ЭКМО или диссинхронии вентилятора.
- Трахеостомия — это процедура, генерирующая аэрозоль, которая может быть разумно отсрочена у пациентов с COVID-19.
- Пациентам с COVID-19 с ОРДС может потребоваться более длительная поддержка ЭКМО, чем другим тяжелобольным пациентам с поддержкой ЭКМО.
- Гиперкоагуляция часто встречается у пациентов с COVID-19, и у них может развиться тромбоз в оксигенаторе ЭКМО или других местах, таких как легкие. Суточные уровни протромбина (PT), частичное тромбопластиновое время (PTT), фибриногена и D-димера получают для мониторинга признаков гиперкоагуляции или диссеминированного внутрисосудистого свертывания (DIC) (таблица 3). Необходим бдительный мониторинг для обеспечения адекватной непрерывной антикоагуляции и поддержания адекватной циркуляции ЭКМО. Большинство учреждений ориентируются на активированное частичное тромбопластиновое время (АПТВ), которое по меньшей мере в 1,5 раза превышает верхний предел нормы, а многие — на более высокий уровень антикоагуляции (например, от 2,0 до 2,5 раз выше верхнего предела нормы). Ежедневная трансторакальная эхокардиография выполняется в некоторых центрах для мониторинга ранних признаков острого легочного сердца, вызванного ПЭ (см. «Поддержание антикоагуляции» выше и «Coronavirus disease 2019 (COVID-19): Hypercoagulability», section on 'Routine testing (all patients)' (Коронавирусное заболевание 2019 (COVID-19): гиперкоагуляция, раздел: рутинное тестирование (все пациенты).
- Улучшения податливости легких и насыщения артериальной крови оксигемоглобином указывают на то, что пациент может быть готов к отлучению от ЭКМО. Как правило, используются институциональные протоколы отлучения (алгоритм 1). После успешного отлучения от ЭКМО обычно необходим дополнительный период времени в интенсивной или тщательно контролируемой помощи для достижения частичного восстановления после делирия вследствие продолжительных периодов седации в отделении интенсивной терапии и / или сильной слабости, которая может возникнуть, если миорелаксанты были временно использованы (см. «Отлучение от ЭКМО» выше).
Ссылки
- Shekar K, Badulak J, Peek G, et al. Extracorporeal Life Support Organization Coronavirus Disease 2019 Interim Guidelines: A Consensus Document from an International Group of Interdisciplinary Extracorporeal Membrane Oxygenation Providers. ASAIO J 2020; 66:707. (Организация экстракорпорального жизнеобеспечения, коронавирусное заболевание 2019, промежуточные руководящие принципы: консенсусный документ международной группы междисциплинарных поставщиков экстракорпоральной мембранной оксигенации)MacLaren G, Fisher D, Brodie D. Preparing for the Most Critically Ill Patients With COVID-19: The Potential Role of Extracorporeal Membrane Oxygenation. JAMA 2020; 323:1245. (Подготовка к наиболее тяжелобольным пациентам с COVID-19: потенциальная роль экстракорпоральной мембранной оксигенации)Bartlett RH, Ogino MT, Brodie D, et al. Initial ELSO Guidance Document: ECMO for COVID-19 Patients with Severe Cardiopulmonary Failure. ASAIO J 2020; 66:472. (Первоначальный руководящий документ ELSO: ЭКМО для пациентов с COVID-19 с тяжелой сердечно-легочной недостаточностью)
- Ramanathan K, Antognini D, Combes A, et al. Planning and provision of ECMO services for severe ARDS during the COVID-19 pandemic and other outbreaks of emerging infectious diseases. Lancet Respir Med 2020; 8:518 (Планирование и предоставление услуг ЭКМО при тяжелых ОРЗ во время пандемии COVID-19 и других вспышек новых инфекционных заболеваний)Li X, Guo Z, Li B, et al. Extracorporeal Membrane Oxygenation for Coronavirus Disease 2019 in Shanghai, China. ASAIO J 2020; 66:475. (Экстракорпоральная мембранная оксигенация при коронавирусной болезни 2019 года в Шанхае, Китай)Quintel M, Bartlett RH, Grocott MPW, et al. Extracorporeal Membrane Oxygenation for Respiratory Failure. Anesthesiology 2020; 132:1257. (Экстракорпоральная мембранная оксигенация при дыхательной недостаточности. Анестезиология 2020)Parhar KKS, Lequier L, Blackwood J, et al. Optimizing provision of extracorporeal life support during the COVID-19 pandemic: practical considerations for Canadian jurisdictions. CMAJ 2020; 192:E372. (Оптимизация обеспечения экстракорпорального жизнеобеспечения во время пандемии COVID-19: практические соображения для канадских юрисдикций)
- Harvey MJ, Gaies MG, Prosser LA. U.S. and International In-Hospital Costs of Extracorporeal Membrane Oxygenation: a Systematic Review. Appl Health Econ Health Policy 2015; 13:341. (Американские и международные внутрибольничные расходы на Экстракорпоральную мембранную оксигенацию: систематический обзор)
- Ñamendys-Silva SA. ECMO for ARDS due to COVID-19. Heart Lung 2020; 49:348. (ЭКМО для ОРЗ из-за COVID-19. Легочное Сердце 2020)
- Zochios V, Brodie D, Charlesworth M, Parhar KK. Delivering extracorporeal membrane oxygenation for patients with COVID-19: what, who, when and how? Anaesthesia 2020; 75:997. (Проведение экстракорпоральной мембранной оксигенации для пациентов с COVID-19: что, кто, когда и как? Анестезия 2020)
- Hamele M, Neumayer K, Sweney J, Poss WB. Always ready, always prepared-preparing for the next pandemic. Transl Pediatr 2018; 7:344. (Всегда готов, всегда готов-готовиться к следующей пандемии. Научный Педиатр)
- Augoustides JGT. Extracorporeal membrane oxygenation - Crucial considerations during the coronavirus crisis. J Cardiothorac Vasc Anesth 2020; (in press). (Экстракорпоральная мембранная оксигенация - важнейшие соображения во время коронавирусного кризиса)
- Osho AA, Moonsamy P, Hibbert KA, et al. Veno-venous Extracorporeal Membrane Oxygenation for Respiratory Failure in COVID-19 Patients: Early Experience From a Major Academic Medical Center in North America. Ann Surg 2020. (Вено-венозная экстракорпоральная мембранная оксигенация при дыхательной недостаточности у пациентов с COVID-19: ранний опыт крупного Академического медицинского центра в Северной Америке)
- Augoustides JG. Extracorporeal Membrane Oxygenation - Crucial Considerations during the Coronavirus Crisis. J Cardiothorac Vasc Anesth 2020; 34:1720. (Экстракорпоральная мембранная оксигенация - важнейшие соображения во время коронавирусного кризиса)
- Sanford Z, Madathil RJ, Deatrick KB, et al. Extracorporeal Membrane Oxygenation for COVID-19. Innovations (Phila) 2020; 15:306. (Экстракорпоральная мембранная оксигенация для COVID-19. Инновации )
- Abrams D, Ferguson ND, Brochard L, et al. ECMO for ARDS: from salvage to standard of care? Lancet Respir Med 2019; 7:108. (ЭКМО для ОРЗ: от спасения до стандарта медицинской помощи)
- Rajagopal K, Keller SP, Akkanti B, et al. Advanced Pulmonary and Cardiac Support of COVID-19 Patients: Emerging Recommendations From ASAIO-a Living Working Document. Circ Heart Fail 2020; 13:e007175. (Расширенная легочная и сердечная поддержка пациентов с COVID-19: новые рекомендации ASAIO-живой рабочий документ)
- Matthay MA, Aldrich JM, Gotts JE. Treatment for severe acute respiratory distress syndrome from COVID-19. Lancet Respir Med 2020; 8:433. (Лечение тяжелого острого респираторного дистресс-синдрома от COVID-19)
- Zeng Y, Cai Z, Xianyu Y, et al. Prognosis when using extracorporeal membrane oxygenation (ECMO) for critically ill COVID-19 patients in China: a retrospective case series. Crit Care 2020; 24:148. (Прогноз при использовании экстракорпоральной мембранной оксигенации (ЭКМО) у критически больных пациентов с COVID-19 в Китае: ретроспективная серия случаев)
- Jacobs JP, Stammers AH, St Louis J, et al. Extracorporeal Membrane Oxygenation in the Treatment of Severe Pulmonary and Cardiac Compromise in Coronavirus Disease 2019: Experience with 32 Patients. ASAIO J 2020; 66:722. (Экстракорпоральная мембранная оксигенация в лечении тяжелых легочных и сердечных нарушений при коронавирусной болезни 2019 года: опыт работы с 32 пациентами)
- Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med 2020; 8:475. (Клиническое течение и исходы тяжелобольных пациентов с пневмонией SARS-CoV-2 в Ухане, Китай: одноцентровое ретроспективное обсервационное исследование)
- Grasselli G, Zangrillo A, Zanella A, et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. JAMA 2020; 323:1574. (Исходные характеристики и исходы 1591 пациента, инфицированного SARS-CoV-2, поступившего в отделение интенсивной терапии региона Ломбардия, Италия)
- Al Gazwi HA, Ibrahim EE, Al Hammad ZA, Al Robeh ZA. Extracorporeal Membrane Oxygenation in Severe ARDS Secondary to Middle East Respiratory Syndrome Coronavirus. Respiratory Care 64. (Экстракорпоральная мембранная оксигенация при тяжелой ОРДС вторичной по отношению к коронавирусу ближневосточного респираторного синдрома)
- Alshahrani MS, Sindi A, Alshamsi F, et al. Extracorporeal membrane oxygenation for severe Middle East respiratory syndrome coronavirus. Ann Intensive Care 2018; 8:3. (Экстракорпоральная мембранная оксигенация при тяжелом коронавирусе ближневосточного респираторного синдрома)
- Sukhal S, Sethi J, Ganesh M, et al. Extracorporeal membrane oxygenation in severe influenza infection with respiratory failure: A systematic review and meta-analysis. Ann Card Anaesth 2017; 20:14. (Экстракорпоральная мембранная оксигенация при тяжелой гриппозной инфекции с дыхательной недостаточностью: систематический обзор и метаанализ)
- Zangrillo A, Biondi-Zoccai G, Landoni G, et al. Extracorporeal membrane oxygenation (ECMO) in patients with H1N1 influenza infection: a systematic review and meta-analysis including 8 studies and 266 patients receiving ECMO. Crit Care 2013; 17:R30. (Экстракорпоральная мембранная оксигенация (ЭКМО) у пациентов с гриппозной инфекцией H1N1: систематический обзор и метаанализ, включающий 8 исследований и 266 пациентов, получающих ЭКМО)
- Patroniti N, Zangrillo A, Pappalardo F, et al. The Italian ECMO network experience during the 2009 influenza A(H1N1) pandemic: preparation for severe respiratory emergency outbreaks. Intensive Care Med 2011; 37:1447. (Опыт итальянской сети ЭКМО во время пандемии гриппа А(H1N1) 2009 года: подготовка к тяжелым респираторным чрезвычайным вспышкам)
- Memom HA, Ratnani I, Masud F. Extracorporeal membrane oxygenation support through Protek Duo Cannula: A case series. Am J Respir Crit Care Med 2018; 197:A5115. (Поддержка экстракорпоральной мембранной оксигенации с помощью канюли Protek Duo: серия кейсов)
- Hoyler MM, Flynn B, Iannacone EM, et al. Clinical Management of Venoarterial Extracorporeal Membrane Oxygenation. J Cardiothorac Vasc Anesth 2020; 34:2776. (Клиническое ведение Веноартериальной экстракорпоральной мембранной оксигенации)
- Deatrick KB, Mazzeffi MA, Galvagno SM Jr, et al. Outcomes of Venovenous Extracorporeal Membrane Oxygenation When Stratified by Age: How Old Is Too Old? ASAIO J 2019. (Результаты Веновенозной экстракорпоральной мембранной оксигенации при стратификации по возрасту: сколько лет слишком много?)
- Gravesteijn BY, Schluep M, Disli M, et al. Neurological outcome after extracorporeal cardiopulmonary resuscitation for in-hospital cardiac arrest: a systematic review and meta-analysis. Crit Care 2020; 24:505.(Неврологический исход после экстракорпоральной сердечно-легочной реанимации при внутрибольничной остановке сердца: систематический обзор и метаанализ)
- Centers for Disease Control: Interim Infection Prevention and Control Recommendations for Patients with Suspected or Confirmed Coronavirus Disease 2019 (COVID-19) in Healthcare Settings https://www.cdc.gov/coronavirus/2019-ncov/hcp/infection-control-recommendations.html (Accessed on May 20, 2020). (Центры по контролю заболеваний: промежуточные рекомендации по профилактике и контролю инфекций для пациентов с подозрением или подтвержденным Коронавирусным заболеванием 2019 года (COVID-19) в медицинских учреждениях)
- Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020; 395:507. (Эпидемиологические и клинические характеристики 99 случаев новой коронавирусной пневмонии 2019 года в Ухане, Китай: описательное исследование)
- Nicolais CD, Suryapalam M, O'Murchu B, et al. Use of Protek Duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. J Am Coll Cardiol 2018; 71. (Использование гноя Протек Дуо тандемного сердца для чрескожной поддержки правого желудочка в различных клинических условиях: серия случаев Протек Дуо тандемное сердце для чрескожной поддержки правого желудочка в различных клинических условиях: серия случаев)
- Kirkpatrick JN, Mitchell C, Taub C, et al. ASE Statement on Protection of Patients and Echocardiography Service Providers During the 2019 Novel Coronavirus Outbreak: Endorsed by the American College of Cardiology. J Am Coll Cardiol 2020; 75:3078. (Заявление ASE о защите пациентов и поставщиков услуг эхокардиографии во время новой вспышки коронавирусного заболевания 2019 года: одобрено Американским колледжем кардиологии)
- Augoustides JG. Perioperative Echocardiography: Key Considerations During the Coronavirus Pandemic. J Cardiothorac Vasc Anesth 2020; 34:1416. (Периоперационная эхокардиография: ключевые соображения во время пандемии коронавируса)
- Wood DA, Mahmud E, Thourani VH, et al. Safe Reintroduction of Cardiovascular Services During the COVID-19 Pandemic: From the North American Society Leadership. J Am Coll Cardiol 2020; 75:3177. (Безопасное восстановление сердечно-сосудистых служб во время пандемии COVID-19: от руководства Североамериканского общества)
- Markin NW, Cawcutt KA, Sayyed SH, et al. Transesophageal Echocardiography Probe Sheath to Decrease Provider and Environment Contamination. Anesthesiology 2020; 133:475. (Оболочка зонда чреспищеводной эхокардиографии для уменьшения загрязнения поставщика и окружающей среды)
- Nicoara A, Maldonado Y, Kort S, et al. Specific Considerations for the Protection of Patients and Echocardiography Service Providers When Performing Perioperative or Periprocedural Transesophageal Echocardiography during the 2019 Novel Coronavirus Outbreak: Council on Perioperative Echocardiography Supplement to the Statement of the American Society of Echocardiography Endorsed by the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2020; 33:666.(Конкретные соображения по защите пациентов и поставщиков услуг эхокардиографии при выполнении Периоперационной или Перипроцедуральной чреспищеводной эхокардиографии во время новой вспышки коронавируса 2019 года: Совет по Периоперационной эхокардиографии дополнение к заявлению американского общества эхокардиографии, одобренному обществом сердечно-сосудистых анестезиологов)
- Teran F, Burns KM, Narasimhan M, et al. Critical Care Transesophageal Echocardiography in Patients during the COVID-19 Pandemic. J Am Soc Echocardiogr 2020; 33:1040. (Чреспищеводная эхокардиография в критическом состоянии у пациентов во время пандемии COVID-19)
- Chimot L, Marqué S, Gros A, et al. Avalon© bicaval dual-lumen cannula for venovenous extracorporeal membrane oxygenation: survey of cannula use in France. ASAIO J 2013; 59:157.(Avalon © бикавальная двухпросветная канюля для веновенозной экстракорпоральной мембранной оксигенации: обзор использования канюли во Франции)
- Kuhl T, Michels G, Pfister R, et al. Comparison of the Avalon Dual-Lumen Cannula with Conventional Cannulation Technique for Venovenous Extracorporeal Membrane Oxygenation. Thorac Cardiovasc Surg 2015; 63:653. (Сравнение Двухпросветной канюли Avalon с традиционной методикой Канюлирования для Веновенозной экстракорпоральной мембранной оксигенации)
- Mazzeffi M, Fischer S. Transesophageal echocardiographic guided placement of a right internal jugular dual-lumen venovenous extracorporeal membrane oxygenation (ECMO) catheter. J Cardiothorac Vasc Anesth 2013; 27:e46.(Чреспищеводная эхокардиографическая направленная установка правого внутреннего яремного двухпросветного веновенозного экстракорпорального мембранного оксигенационного катетера (ЭКМО))
- Betancor J, Xu B, Rehman KA, et al. Transesophageal Echocardiographic Guidance of Venovenous Extracorporeal Membrane Oxygenation Cannula (Avalon Cannula) Repositioning. CASE (Phila) 2017; 1:150. (Чреспищеводное Эхокардиографическое руководство репозицией Веновенозной экстракорпоральной мембранной Оксигенационной канюли (канюля Авалона))
- Chacon MM, Shillcutt SK. Intraoperative Transesophageal Echocardiography-Guided Placement of Bicaval Dual-Lumen Extracorporeal Membrane Oxygenation Cannula. CASE (Phila) 2017; 1:116. (Интраоперационная чреспищеводная эхокардиография-направленное размещение Бикавальной Двухпросветной экстракорпоральной мембранной Оксигенационной канюли)
- Dolch ME, Frey L, Buerkle MA, et al. Transesophageal echocardiography-guided technique for extracorporeal membrane oxygenation dual-lumen catheter placement. ASAIO J 2011; 57:341.(Чреспищеводная эхокардиография-направленный метод экстракорпоральной мембранной оксигенации с размещением двухпросветного катетера)
- Griffee MJ, Zimmerman JM, McKellar SH, Tonna JE. Echocardiography-Guided Dual-Lumen Venovenous Extracorporeal Membrane Oxygenation Cannula Placement in the ICU-A Retrospective Review. J Cardiothorac Vasc Anesth 2020; 34:698.(Эхокардиография-направленная Двухпросветная Веновенозная экстракорпоральная мембранная оксигенация размещение канюли в отделении интенсивной терапии-ретроспективный обзор)
- Mustafa AK, Alexander PJ, Joshi DJ, et al. Extracorporeal Membrane Oxygenation for Patients With COVID-19 in Severe Respiratory Failure. JAMA Surg 2020.(Экстракорпоральная мембранная оксигенация для пациентов с COVID-19 при тяжелой дыхательной недостаточности)
- Abrams D, Bacchetta M, Brodie D. Recirculation in venovenous extracorporeal membrane oxygenation. ASAIO J 2015; 61:115.(Рециркуляция при венозной экстракорпоральной мембранной оксигенации)
- Burrell AJC, Ihle JF, Pellegrino VA, et al. Cannulation technique: femoro-femoral. J Thorac Dis 2018; 10:S616. (Техника канюлирования: бедренно-бедренная)
- Hanidziar D, Bittner EA. Sedation of Mechanically Ventilated COVID-19 Patients: Challenges and Special Considerations. Anesth Analg 2020; 131:e40.(Седация механически вентилируемых пациентов с COVID-19: проблемы и особые соображения)
- Blanch L, Villagra A, Sales B, et al. Asynchronies during mechanical ventilation are associated with mortality. Intensive Care Med 2015; 41:633.(Асинхронность при искусственной вентиляции легких связана со смертностью)
- Martyn JAJ, Mao J, Bittner EA. Opioid Tolerance in Critical Illness. N Engl J Med 2019; 380:365.(Толерантность к опиоидам при критических заболеваниях)
- Portugal LG, Adams DR, Baroody FM, Agrawal N. A Surgical Safety Checklist for Performing Tracheotomy in Patients with Coronavirus Disease 19. Otolaryngol Head Neck Surg 2020; 163:42.(Контрольный список хирургической безопасности при выполнении трахеотомии у пациентов с коронавирусной болезнью. Отоларингологическая головка)
- Tay JK, Khoo ML, Loh WS. Surgical Considerations for Tracheostomy During the COVID-19 Pandemic: Lessons Learned From the Severe Acute Respiratory Syndrome Outbreak. JAMA Otolaryngol Head Neck Surg 2020; 146:517.(Хирургические соображения по поводу трахеостомии во время пандемии COVID-19: уроки, извлеченные из вспышки тяжелого острого респираторного синдрома)
- Chow JH, Mazzeffi MA, McCurdy MT. Angiotensin II for the Treatment of COVID-19-Related Vasodilatory Shock. Anesth Analg 2020; 131:102.(Ангиотензин II для лечения связанного с COVID-19 сосудорасширяющего шока)
- Hekimian G, Brechot N, Luyt C-E, et al. Severe pulmonary embolism in COVID-19 patients: a call for increased awareness. Crit Care 2020; (in press).(Тяжелая легочная эмболия у пациентов с COVID-19: призыв к повышению осведомленности)
- Xie Y, Wang X, Yang P, et al. COVID-19 complicated by acute pulmonary embolism. Radiology: Cardiothoracic Imaging 2020; 2:e200067.(COVID-19 осложнился острой тромбоэмболией легочной артерии. Радиология: Кардиоторакальная Визуализация)
- Danzi GB, Loffi M, Galeazzi G, Gherbesi E. Acute pulmonary embolism and COVID-19 pneumonia: a random association? Eur Heart J 2020; 41:1858.(Острая легочная эмболия и пневмония COVID-19: случайная ассоциация?)
- Augoustides JGT. Cardiovascular consequences and considerations of cornavirus infection - perspectives for the cardiothoracic anesthesiologist and intensivist during the coronavirus crisis. J Cardiothorac Vasc Anesth 2020; (in press).(Сердечно - сосудистые последствия и соображения о корнавирусной инфекции- перспективы для кардиоторакального анестезиолога и реаниматолога во время коронавирусного кризиса)
- Lamb KM, DiMuzio PJ, Johnson A, et al. Arterial protocol including prophylactic distal perfusion catheter decreases limb ischemia complications in patients undergoing extracorporeal membrane oxygenation. J Vasc Surg 2017; 65:1074.(Артериальный протокол включающий профилактический дистальный перфузионный катетер уменьшает осложнения ишемии конечностей у пациентов подвергающихся экстракорпоральной мембранной оксигенации)
- Williams B, Bernstein W. Review of Venoarterial Extracorporeal Membrane Oxygenation and Development of Intracardiac Thrombosis in Adult Cardiothoracic Patients. J Extra Corpor Technol 2016; 48:162.(Обзор Веноартериальной экстракорпоральной мембранной оксигенации и развития внутрисердечного тромбоза у взрослых кардиоторакальных больных)
- Levi M, Thachil J, Iba T, Levy JH. Coagulation abnormalities and thrombosis in patients with COVID-19. Lancet Haematol 2020; 7:e438.(Нарушения свертываемости крови и тромбоз у пациентов с COVID-19)
- Arachchillage DRJ, Laffan M. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020; 18:1233.(Аномальные параметры свертывания крови связаны с плохим прогнозом у пациентов с новой коронавирусной пневмонией)
- Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 2020; 191:145.(Частота тромботических осложнений у тяжелобольных пациентов отделения интенсивной терапии с COVID-19)
- Zhang Y, Xiao M, Zhang S, et al. Coagulopathy and Antiphospholipid Antibodies in Patients with Covid-19. N Engl J Med 2020; 382:e38.(Коагулопатия и Антифосфолипидные антитела у пациентов с Covid-19)
- Griffin DO, Jensen A, Khan M, et al. Pulmonary Embolism and Increased Levels of d-Dimer in Patients with Coronavirus Disease. Emerg Infect Dis 2020; 26:1941.(Тромбоэмболия легочной артерии и повышенный уровень d-димера у пациентов с коронавирусной болезнью.)
- Hékimian G, Lebreton G, Bréchot N, et al. Severe pulmonary embolism in COVID-19 patients: a call for increased awareness. Crit Care 2020; 24:274.(Тяжелая легочная эмболия у пациентов с COVID-19: призыв к повышению осведомленности)
- Hu D, Liu K, Li B, Hu Z. Large intracardiac thrombus in a COVID-19 patient treated with prolonged extracorporeal membrane oxygenation implantation. Eur Heart J 2020; 41:3104.(Большие внутрисердечные тромбы в COVID-19 пациент с длительной экстракорпоральной мембранной оксигенации имплантации)
- Schmiady MO, Sromicki J, Kucher N, Ouda A. Successful percutaneous thrombectomy in a patient with COVID-19 pneumonia and acute pulmonary embolism supported by extracorporeal membrane oxygenation. Eur Heart J 2020; 41:3107.(Успешная чрескожная тромбэктомия у пациента с пневмонией COVID-19 и острой тромбоэмболией легочной артерии при поддержке экстракорпоральной мембранной оксигенации)
- Panigada M, Bottino N, Tagliabue P, et al. Hypercoagulability of COVID-19 patients in intensive care unit: A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost 2020; 18:1738.(гиперкоагуляционная способность пациентов с COVID-19 в отделении интенсивной терапии: отчет о результатах тромбоэластографии и других параметрах гемостаза)
- Cunningham D, Besser MW, Giraud K, et al. Agreement between ACT and aPTT during extracorporeal membrane oxygenation shows intra- and inter-individual variation. Perfusion 2016; 31:503. (Согласие между ACT и aPTT во время экстракорпоральной мембранной оксигенации показывает внутри - и меж-индивидуальные вариации. Перфузия
- Koster A, Ljajikj E, Faraoni D. Traditional and non-traditional anticoagulation management during extracorporeal membrane oxygenation. Ann Cardiothorac Surg 2019; 8:129. (Традиционное и нетрадиционное антикоагулянтное лечение при экстракорпоральной мембранной оксигенации)
- Hellmann C, Schmutz A, Kalbhenn J. Bleeding during veno-venous ECMO cannot reliably be predicted by rotational thrombelastometry (ROTEM™). Perfusion 2018; 33:289.(Кровотечение во время вено-венозной ЭКМО не может быть достоверно предсказано ротационной тромбеластометрией)
- Barbaro RP, Odetola FO, Kidwell KM, et al. Association of hospital-level volume of extracorporeal membrane oxygenation cases and mortality. Analysis of the extracorporeal life support organization registry. Am J Respir Crit Care Med 2015; 191:894. (Ассоциация госпитального объема случаев экстракорпоральной мембранной оксигенации и смертности. Анализ реестра организаций экстракорпорального жизнеобеспечения)
- Henry BM, Lippi G. Poor survival with extracorporeal membrane oxygenation in acute respiratory distress syndrome (ARDS) due to coronavirus disease 2019 (COVID-19): Pooled analysis of early reports. J Crit Care 2020; 58:27. (Плохая выживаемость при экстракорпоральной мембранной оксигенации при остром респираторном дистресс-синдроме (ОРДС) вследствие коронавирусной болезни 2019 года (COVID-19): Объединенный анализ ранних сообщений)
- Yang X, Cai S, Luo Y, et al. Extracorporeal Membrane Oxygenation for Coronavirus Disease 2019-Induced Acute Respiratory Distress Syndrome: A Multicenter Descriptive Study. Crit Care Med 2020; 48:1289. (Экстракорпоральная мембранная оксигенация при остром респираторном дистресс-синдроме, вызванном коронавирусной болезнью 2019 года: многоцентровое описательное исследование)
- Bhatraju PK, Ghassemieh BJ, Nichols M, et al. Covid-19 in Critically Ill Patients in the Seattle Region - Case Series. N Engl J Med 2020; 382:2012. (Covid-19 у критически больных пациентов в регионе Сиэтл - серия случаев)
- Knudson KA, Gustafson CM, Sadler LS, et al. Long-term health-related quality of life of adult patients treated with extracorporeal membrane oxygenation (ECMO): An integrative review. Heart Lung 2019; 48:538. (Долгосрочное качество жизни взрослых пациентов, получавших экстракорпоральную мембранную оксигенацию (ЭКМО): Интегративный обзор)
- Pulton D, Kiefer J, Vernick W, et al. Prognostication of Patients on Venovenous Extracorporeal Membrane Oxygenation for Influenza-Induced Respiratory Failure: Best Practice and Holistic Implications. J Cardiothorac Vasc Anesth 2020; 34:1431. (Прогнозирование пациентов на Веновенозную Экстракорпоральную мембранную оксигенацию при гриппозно-индуцированной дыхательной недостаточности: передовая практика и холистические последствия)
- McDonald MD, Lane-Fall M, Miano TA, et al. The Effect of Sedation on Long-Term Psychological Impairment After Extracorporeal Life Support. J Cardiothorac Vasc Anesth 2020; 34:663. (Влияние седации на длительные психологические нарушения после экстракорпорального жизнеобеспечения)
- Vittori A, Lerman J, Cascella M, et al. COVID-19 Pandemic Acute Respiratory Distress Syndrome Survivors: Pain After the Storm? Anesth Analg 2020; 131:117. (Выжившие после пандемии острого респираторного дистресс-синдрома COVID-19: боль после шторма?)