Гистиоцитарная гиперплазия с гемофагоцитозом и острое повреждение альвеол при инфекции COVID-19

Оригинал: Histiocytic hyperplasia with hemophagocytosis and acute alveolar damage in COVID-19 infection
Автор: Laura Prieto-Pérez et al.
Опубликовано: Nature (Modern Pathology) 03.07.2020
Перевод: Флёрова Елизавета
Абстракт
Спектр проявлений инфекции COVID-19 включает острый респираторный дистресс-синдром (ОРДС) и синдром активации макрофагов (САМ), хотя гистологическая основа этих нарушений до конца не изучена. Посмертные биопсии легких и костного мозга были выполнены у 33 пациентов. Образцы были исследованы морфологически и иммуногистохимически. Также проводилось прижизненное исследование костного мозга у трех пациентов. Посмертные исследования костного мозга показали значительные изменения в виде гистиоцитарной гиперплазии с гемофагоцитозом (ГГГ) в большинстве (16/17) случаев. Подобные изменения, похожие на гемофагоцитарный гистиоцитоз,наблюдались также и у трех живых пациентов. Изменения в легких включали сочетание диффузного альвеолярного повреждения с фибриновыми микротромбами, преимущественно поражающими мелкие сосуды, в частности альвеолярные капилляры. Связь этих результатов с аналитическими данными и клиническими симптомами помогает нам понять (природу) дыхательной недостаточности и выявить гистологический субстрат синдрома активации макрофагов, развившийся у этих пациентов. Наши результаты подтверждают, что инфекция COVID-19 запускает системный иммуновоспалительный процесс, а это позволяет рекомендовать специфическую терапию.
Общие сведения
Спектр проявлений инфекции COVID-19 варьирует от бессимптомного заболевания и респираторной инфекции легкой степени до тяжелой пневмонии, острого респираторного дистресс-синдрома (ОРДС), полиорганной недостаточности и смерти. Вирус вызывает выделение воспалительных цитокинов, и искаженный ими иммунный ответ может привести к полиорганной недостаточности и ОРДС [1]. Все больше данных свидетельствуют о том, что у пациентов с тяжелым течением заболевания может наблюдаться нерегулируемое системное воспаление в сочетании с синдромом цитокинового шторма, что ведет к летальному исходу [1,2].
Растет интерес к изучению гистопатологии органов, пораженных COVID-19 инфекцией, образцы которых получают с помощью биопсии или аутопсии. Новые данные могут обеспечить лучшее понимание болезни и позволить разработать новые подходы к лечению.
Легочная патология SARS была подробно описана [3, 4, 5, 6]. Известно, что имеет место сочетание диффузного альвеолярного повреждения и отека, бронхиолярного фибрина, гиперплазии пневмоцитов II типа, плоскоклеточной метаплазии, многоядерных гигантских клеток и, в некоторых случаях, острой бронхопневмонии. Гиалиновые мембраны были также выявлены в острой фазе диффузного альвеолярного повреждения (ДАП) [3, 4]. Также описаны примеры патологических изменений в легких у пациентов с COVID-19 [5, 6, 7, 8, 9, 10, 11], сходные с обнаруженными при SARS.
В нескольких исследованиях, где производились вскрытия пациентов, умерших от инфекции SARS или MERS, отсутствовали значимые изменения костного мозга [4, 12]. Однако, несмотря на обилие аналитических данных, свидетельствующих о том, что костный мозг может играть значительную роль в патогенезе болезни, нам не известно ни одного гистологического описания костного мозга в контексте инфекции COVID-19.
В этой статье мы опишем некоторые гистологические находки в посмертных образцах легких и костного мозга пациентов, умерших от инфекции COVID-19, и обсудим, как это способствует пониманию заболевания. Кроме того, мы опишем клинические и гистологические данные от живых пациентов с COVID-19, соответствующих критериям диагностики гемофагоцитарного синдрома, и сравним их с данными от умерших пациентов.
Методы
Дизайн исследования
Посмертные биопсии пациентов, умерших с диагнозом COVID-19, были выполнены между 18 марта и 17 апреля 2020 года (n = 33). Костный мозг и ткань легких были отобраны для исследования исходя из того, что понимание патологических изменений у этих пациентов поможет объяснить их клиническую картину.
Посмертный интервал между смертью и биопсией составил менее 3 часов в каждом случае. За это время информированное согласие было получено от семьи каждого пациента. Это исследование было одобрено местной контрольной комиссией и Комитетом по Этике IIS-University Hospital Fundación Jiménez Díaz в Мадриде, Испания.
Были получены 22 образца легких и 17 образцов костного мозга; у 16 пациентов оба образца (легких и костного мозга) были доступны к исследованию.
Кроме того, имелись плановые биопсии костного мозга трех пациентов, двое из которых имели предшествующий анамнез гематологического заболевания.
Техника биопсии
Образцы легких были взяты в случайных областях путем чрескожного прокола с помощью 33-мм 14 G иглы автоматического биопсийного пистолета, и помещены в формальдегид на 72 часа перед исследованием. Все биопсии костного мозга были взяты из задневерхней подвздошной ости, фиксированы и обработаны как обычные биопсии костного мозга с использованием реагентов Myelodec® (Bio-Optica).
Другие ткани, полученные в ходе вскрытия, не были включены в это исследование.
Дополнительные процедуры
В каждом случае инфекция SARS-CoV-2 была подтверждена RT-PCR (ПЦР в реальном времени) из материала мазков носоглотки (Viasure® SARS-CoV-2 набор для ПЦР в реальном времени).
Ткани были исследованы с помощью световой микроскопии в соответствии со стандартными протоколами окрашивания гематоксилин-эозином и иммуногистохимически (ИГХ). Тест COVID19 ИГХ был сделан с использованием антитела GTX632604 (Genetex), которое обнаруживает как шипик SARS-CoV, так и шипиковые белки SARS-CoV-2 (субъединица S2). CD163 (CM353A) антитело было получено из Biocare и антитела к гликофорину A (M0819) был получены от DAKO.
Непрерывные (количественные) переменные выражаются как медиана и межквартильный размах (МКР; Interquartile range, IQR); качественные переменные суммируются как пропорции. Статистический анализ был выполнен с помощью SPSS v20.0 (IBM® Corp., Армонк, Нью-Йорк, США).
Результаты
Клинические характеристики
Умершие пациенты
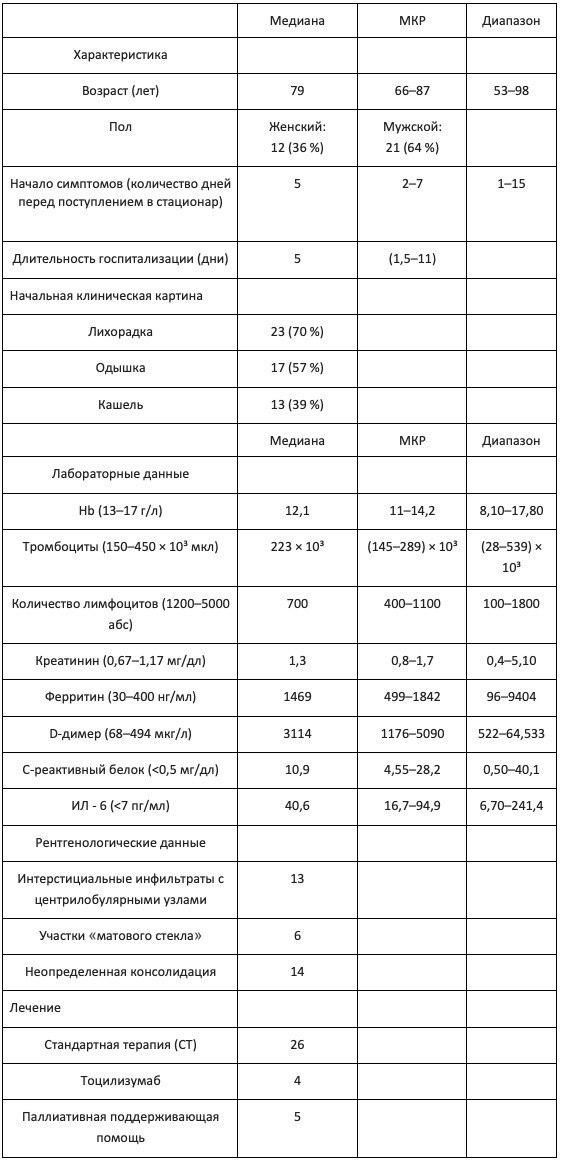
Медиана возраста 33 пациентов составила 79 лет (53—98 года); 36 % составили женщины. Большинство пациентов имели хронические заболевания, из которых наиболее часто встречались гипертоническая болезнь (45 %), сахарный диабет (30 %), заболевания легких (27 %), и заболевания сердца (18 %). Симптомы болезни возникли за 1–15 дней до поступления в стационар. Среднее время от госпитализации до смерти составило 5 дней (МКР 1,5–11) с самым длительным сроком госпитализации 27 дней. Три пациента умерло в течение 24 часов после поступления, девять пациентов умерло после лечения в отделении интенсивной терапии с необходимостью проведения искусственной вентиляции легких, 16 пациентов получили стандартное лечение во время госпитализации, и паллиативная помощь была оказана пяти пациентам. По результатам лабораторных исследований отмечалось повышение уровня D-димера (медиана, 3114 мкг / л [диапазон, 1176–5090 мкг / л]), ферритина (медиана, 1469 мкг / л [диапазон 499–1842 мкг / л]), лимфопения (медиана, 700 мкг / л [диапазон 400–1100 мкг / л]) иИЛ-6 (медиана, 40,6 мкг/л [диапазон 16,7–94,9 мкг/л]). Клинические особенности, симптомы, рентгенологические, лабораторные данные и лечение отражены в таблице 1.
Таблица 1 Демографические и клинические характеристики на момент смерти (N = 33 случая).
СТ Стандартная терапия по протоколу (protocol-based standard-therapy, PB-ST): гидроксихлорохин, LPV/r, метилпреднизолон, низкомолекулярный гепарин и антибиотик (левофлоксацин, доксициклин или азитромицин). МКР межквартильный размах.
Гемофагоцитарный лимфогистиоцитоз у живых пациентов
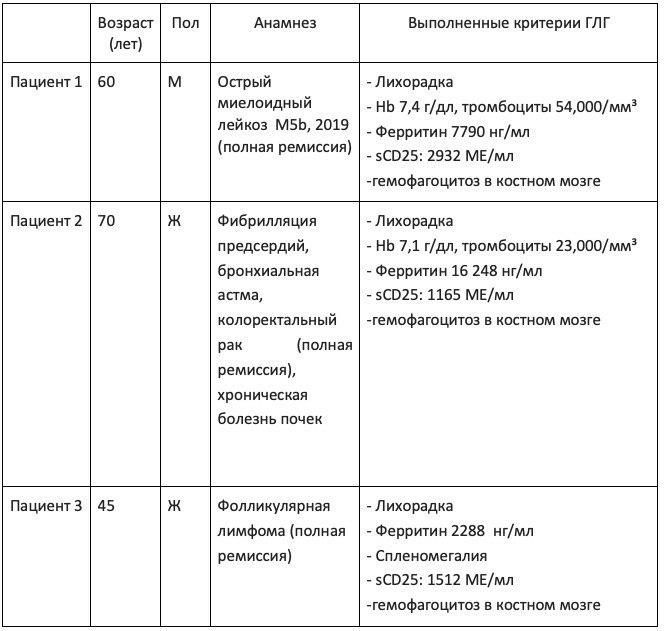
В связи с высокой вероятностью гемофагоцитарного лимфогистиоцитоза на основании клинических данных, у трех живых пациентов была произведена биопсия костного мозга. Клинические особенности живых пациентов с подтвержденным ГЛГ отражены в таблице 2.
Таблица 2 Демографические и клинические характеристики живых пациентов сподтвержденным ГЛГ (N = 3 случая).
ГЛГ Гемофагоцитарный лимфогистиоцитоз
Гистология костного мозга
Было отмечено относительное увеличение общей клеточности костного мозга во всех случаях; наиболее выраженным признаком было наличие отдельных макрофагов с поглощенными эритроцитами и эритробластами (рис. 1). Хотя отношение этих клеток отличалось от случая к случаю, они присутствовали в 16/17 случаях. Окрашивание с помощью CD163 и двойное окрашивание CD163/Гликофорин (маркер эритроцитов) позволило обнаружить это явление (рис. 1). Также часто встречались макрофаги, содержащие гемосидерин. Иногда отмечались многоядерные гистиоциты. Кроме того, большинство образцов содержали агрегаты CD8+ интерстициальных лимфоцитов и иногда интерстициальные первичные лимфоидные фолликулы. Плазматические клетки присутствовали в количестве от 1 до 4%.
Во всех случаях миелоидные клетки были более распространены, соотношение миелоидных/эритроидных (M:E) клеток составило от 4 до 8. В большинстве случаев в миелоидном ростке наблюдалась относительно более высокая доля миелоцитов + метамиелоцитов, с относительно более низкой долей зрелых нейтрофилов.
Другие особенности в образцах костного мозга включали частые скопления мегакариоцитов. Гранулемы отсутствовали во всех случаях.
Результаты приведены в таблице 3.
Кроме того, у трех живых пациентов с COVID-19, у которых имелись достаточные критерии для постановки диагноза вторичный гистиоцитарный лимфогистиоцитоз (вГЛГ), в образцах костного мозга были обнаружены сходные изменения со значительным эритрофагоцитозом.
Таблица 3. Основные изменения в костном мозге
Рис. 1. Гистология костного мозга.
В препаратах костного мозга отмечается повышенная клеточность, наличие CD 163-положительныхмакрофагов и выраженный гемофагоцитоз, что показано двойным окрашиванием с CD163 и гликофорином.
Гистология легких
Из 22 полученных образцов легких два были непригодны для соответствующего гистопатологического анализа.
Наиболее часто встречались поражения по типу острого ДАП (диффузного альвеолярного повреждения) с частым образованием гиалиновых мембран, связанных с фибрином и внутриальвеолярным клеточным детритом; очаговые признаки организации экссудата присутствовали в 14 из 20 пригодных для анализа образцов, а еще в двух образцах признаки организации преобладали. Плоскоклеточная метаплазия была обнаружена в трех образцах, а в четырех других - очаги бронхопневмонии. Поражения по типу ДАП одинаковой интенсивности присутствовали у пациентов, получавших лечение как в ОРИТ, так и вне реанимации (Рис. 2 и 3).
У 12 пациентов были выявлены многочисленные фибриновые микротромбы, которые преимущественно поражали мелкие сосуды, в частности, альвеолярные капилляры, однако признаки васкулита отсутствовали (рис. 3).
ИГХ исследование COVID-19 было выполнено в одном случае и показало наличие отдельных COVID-19-положительных пневмоцитов (рис. 4).
Во всех случаях был обнаружен неравномерно распределенный лимфогистиоцитарный воспалительный инфильтрат. ИГХ исследование выявило наличие многочисленных CD163-положительных макрофагов, расположенных как в интерстициальных, так и в альвеолярных пространствах. Иногда внутри этих CD163 + макрофагов обнаруживались поглощенные нейтрофилы. Также определялись отдельные CD8+ клетки; не было обнаружено связи между количеством CD8 клеток и степенью альвеолярного повреждения (рис. 2 и 4).
Основные изменения в легких приведены в таблице 4.
Клетки TH17 и T-reg отсутствовали в препаратах легких после окрашивания RORGamma и FOXP3. Незначительное или минимальное количество В-клеток было обнаружено в ткани легких после окрашивания CD20 и CD79.
В двух случаях образцы легких исследованы с помощью электронной микроскопии. Подтвердилось наличие микротромбоза и признаков повреждения эндотелия и пневмоцитов II типа, а также получены многочисленные изображения вирусных частиц, по морфологии и размеру соответствующих коронавирусам (рис. 5).
Рис.2 Гистология легких
Гистологические изменения при остром диффузном альвеолярном повреждении с образованием гиалиновых мембран и гиперплазией пневмоцитов II типа, ассоциированные с фибрином и внутриальвеолярным клеточным детритом, рассеянными тромбами.
Рис.3 Тромбоз альвеолярных микрокапилляров
Показано с помощью морфологических методов (ГЭ), окрашиванием по Массону и ИГХ для FVIII с целью определения тромбоцитов и эндотелиальных клеток.
Рис. 4 ИГХ окраска образцов легких: большое количество CD165-положительных макрофагов. Также имеется CD8-положительный интерстициальный лимфоцитоз. Отдельные COVID-19-положительные пневмоциты при ИГХ окраске.
Рис. 5. Электронная микроскопия образцов ткани легких у двух пациентов. Случай 20-262: картина капиллярного тромбоза. b Случай 20–262: Цитоплазматические везикулы, содержащие частицы, соответствующие размеру и морфологии коронавируса. c Случай 20–263: сферические коронавирусные частицы, сгруппированные в мембране.
Таблица 4 Частота основных изменений в легких
Обсуждение
При гистопатологических и ИГХ исследованиях материалов пациентов с COVID-19 были получены неожиданные данные, которые позволяют лучше понять специфические клинические особенности этого заболевания. Мы исследовали биоптаты легких и костного мозга, полученные сразу после смерти пациентов, что позволило провести подробное морфологическое и иммуногистохимическое исследование свежевыделенных тканей. Легкие и костный мозг были выбраны для исследования из-за частоты поражения и клинической значимости при COVID-19.
В легких обнаруживается поражение по типу диффузного альвеолярного повреждения (ДАП), похожее на описанное при остром респираторном дистресс-синдроме (ОРДС), и в исследованиях по вскрытию при COVID-19 [5, 6, 7, 9, 10, 11]. ДАП может вызываться различными патогенами, в том числе вирусами. Наши результаты совпадают с результатами Franks и Hwangetal., которые изучали материал пациентов, умерших от SARS инфекции во время вспышки в 2003 году [3, 13].
Особое внимание было уделено исследованию образцов легких, чтобы оценить, есть ли повреждения как пневмоцитов II типа, так и эндотелиальных клеток. Электронное микроскопическое исследование выявило серьезные повреждения клеток обоих типов, что в значительной степени соответствует наличию в них вирусных частиц.
Хотя никаких признаков легочной ишемии не выявлено, фибриновые микротромбы присутствуют в большом количестве в 12/20 (60 %) образцов, что согласуется с ранее опубликованными данными [5, 6, 7, 9, 10, 11]. Увеличение уровня D-димера было обнаружено у большинства из 33 умерших пациентов в последнем лабораторном исследовании, проведенном перед их смертью, с медианой 3114 мкг/л (диапазон, 522–64 533 мкг/л) и у более, чем половины пациентов, значение D-димера было выше 3000 мкг/л. Коагулопатия при коронавирусной инфекции ассоциирована с вероятностью смертности, при этом уровень D-димера является особенно важным маркером [14]. Как недавно показано Tangetal., антикоагулянтная терапия, в основном НМГ, по-видимому, улучшает прогноз у пациентов с тяжелым течением COVID-19, которые соответствуют критериям сепсис-индуцированной коагулопатии (СИК), или у которых заметно повышен уровень D-димера [15]. Обе характеристики используются для определения риска тромботических событий при коронавирусной инфекции [16]. Тем не менее, тромбоцитопения, один из критериев СИК, присутствовала только у одного пациента, которому ранее был поставлен диагноз кортикостероид-зависимой иммунной тромбоцитопении.
Результаты исследования биопсий костного мозга, проведенных посмертно и у живых пациентов, подтверждают диагноз гемофагоцитарного гистиоцитоза (ГГ). ГГ — частая находка, связанная с тяжелыми вирусными заболеваниями и представляющая собой гистологический аналог синдрома активации макрофагов (САМ), которым страдают данные пациенты. САМ, который также известен как вторичный гистиоцитарный лимфогистиоцитоз (вГЛГ) - это мало изученный синдром, характеризующийся чрезмерной активацией цитотоксических Т-клеток с макрофагальным гемофагоцитозом и массивным выделением воспалительных цитокинов. В связи с этим он входит в классификацию других синдромов цитокинового шторма. В дополнение к первичной форме, большинство случаев ассоциированы и индуцированы злокачественными новообразованиями или различными инфекциями (вирусами, бактериями, грибами или паразитами) [17], и возникаютв 3,7–4,3 % случаев сепсиса [18].
Цитокиновый профиль, напоминающий вГЛГ, ассоциирован с тяжестью COVID-19 и характеризуется повышенным уровнем интерлейкина (ИЛ)-2, ИЛ-7, г-КСФ, интерферон-γ-индуцируемого белка 10, моноцитарного хемоаттрактантного белка 1, воспалительного белка макрофагов 1-α и фактора некроза опухоли-α [2]. Сходство между САМ и вГЛГ уже отмечалось, а также высказывалось предположение о том, что более сильный иммунный ответ, наблюдаемый у этих пациентов, может привести к COVID-19-связанному ОРДС [2, 19]. Повышенный уровень ферритина поддерживает эту гипотезу, и согласуется с выводами нашего исследования, в котором мы определили средний уровень ферритина как 1469 нг/мл (диапазон, 96–9404 нг/мл).
Окончательный диагноз ГЛГ требует выполнения пяти из восьми диагностических критериев ГЛГ-2004 [20]. Случаи, описанные здесь, не отвечают всем критериям, необходимым для постановки диагноза вторичного ГЛГ [21], хотя, опираясь на повторное обнаружение эритрофагоцитоза в образцах костного мозга, мы полагаем, что эти случаи могут представлять собой отдельное гемофагоцитарное расстройство, связанное с COVID-19. Гистиоцитарная гиперплазия с гемофагоцитозом (ГГГ) была описана как частая находка в исследованиях, проведенных при вскрытии тяжело больных пациентов [22], но некоторые из случаев, обозначенных как ГГГ, могут соответствовать спектру ГЛГ. Кроме того, мы публикуем данные о трех живых пациентах с такими же гистологическими результатами, которые соответствовали клинико-аналитическим критериям для диагноза ГЛГ. Эта информация может иметь значение при выборе лечения, так как известно, что пациенты с ГЛГ могут реагировать на комбинацию этопозида, дексаметазона и циклоспорина А [21, 23].
До сих пор неясно, является ли поражение сосудов, частое явление у пациентов с COVID-19, следствием прямого инфицирования эндотелия вирусом или оно развивается вторично по отношению к САМ/ГЛГ, тяжелому расстройству, где, в дополнение к постоянной лихорадке, цитопении и гиперферритинемии, примерно у 50 % пациентов обнаружены поражения легких по типу ОРДС [19]. Таким образом, основной чертой САМ/вГЛГ является гиперактивация тканевых макрофагов, ведущая к цитокиновому шторму, который приводит к быстро прогрессирующей органной недостаточности, чаще всего проявляющейся в виде панцитопении, тканевого гемофагоцитоза, гепатобилиарной дисфункции, диссеминированного внутрисосудистого свертывания (ДВС-синдрома) и дисфункции центральной нервной системы. При САМ, экспрессия растворимого CD163 значительно повышена и отражает большое число активированных макрофагов [18], что также показано во всех исследованных образцах ткани в данном исследовании.
Наши результаты подтверждают, что ткани человека, поврежденные инфекцией COVID-19 действительно обладают совокупностью черт, соответствующих гипотезе, что COVID-19 вызывает системную иммуновоспалительную реакцию. Этоподдерживает предположение о том, что использование противоцитокиновой терапии, ингибирующей провоспалительные цитокины ИЛ-1 и ИЛ-6, является эффективным терапевтическим подходом. Это уменьшает избыточное воспаление, которое может возникнуть в сочетании с вирус-индуцированным ОРДС, при котором аутокринная петля избыточной секреции интерлейкина (ИЛ)-1β приводит к цитокиновому шторму ИЛ-6, ИЛ-18, ферритина и интерферон-гамма [18, 19].
Благодарности
Прежде всего, мы хотели бы выразить нашу глубочайшую признательность пациентам и их семьям, которые в столь скорбное время способствовали нашему пониманию этой болезни. Мы также благодарны всей команде врачей и медицинского персонала за их неутомимую, альтруистическую преданность делу, вложенные силы и старания во время текущей пандемии. Мы хотели бы поблагодарить Ángeles Montero-Fernández, PhD из Manchester University NHS Foundation Trust, и Miguel Lafarga PhD, из Universidad de Cantabria-IDIVAL, которые помогли интерпретировать результаты. Мы благодарим Guido Rodríguez и Juan S. Verde из «Yo, Doctor» за разработку и исполнение наглядного абстракта. Наконец, мы обязаны Laura Cereceda, за ее ценную роль в качестве менеджера по обработке данных.
Финансирование
MA Piris получил гранты от Instituto de Salud Carlos III, от Ministerio de Economía, Industria y Competitividad [PIE15/0081 and PIE16/01294; SAF2013-47416-R, CIBERONCISCIII, ISCIII-MINECO-AES-FEDER (Plan Estatal I+D+I 2013–2016)], от Asociación Española Contra el Cáncer [AECC PROYE18054PIRI], и от Comunidad Autónoma de Madrid [CAM B2017/BMD-3778, PIC97/2017_FJD].B2017 / BMD-3778, PIC97 / 2017_FJD].
Соответствие этическим стандартам
Конфликт интересов Авторы заявляют, что конфликт интересов отсутствует.
Примечание издателя SpringerNature остается нейтральным в отношении юрисдикционных претензий опубликованных карт и институциональных аффиляций.
Список литературы
- Channappanavar R, Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol. 2017;39:529–39.
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ, et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395:1033–4.
- Franks TJ, Chong PY, Chui P, Galvin JR, Lourens RM, Reid AH, et al. Lung pathology of severe acute respiratory syndrome (SARS): a study of 8 autopsy cases from Singapore. Hum Pathol. 2003;34:743–8.
- Ding Y, Wang H, Shen H, Li Z, Geng J, Han H, et al. The clinical pathology of severe acute respiratory syndrome (SARS): a report from China. J Pathol. 2003;200:282–9.
- Menter T, Haslbauer JD, Nienhold R, Savic S, Hopfer H, Deigendesch N, et al. Post-mortem examination of COVID19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings of lungs and other organs suggesting vascular dysfunction. Histopathology. 2020. https://doi.org/10. 1111/his.14134.
- Zhang H, Zhou P, Wei Y, Yue H, Wang Y, Hu M, et al. Histopathologic changes and SARS-CoV-2 immunostaining in the lung of a patient with COVID-19. Ann Intern Med. 2020;172:629–32.
- Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY. Pulmonary pathology of early-phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol. 2020;15:700–4.
- Xu X, Barth RF, Buja LM. A call to action: the need for autopsies to determine the full extent of organ involvement associated with COVID-19 infections. Chest. 2020. https://doi.org/10.1016/j. chest.2020.03.060.
- Barton LM, Duval EJ, Stroberg E, Ghosh S, Mukhopadhyay S. COVID-19 autopsies, Oklahoma, USA. Am J Clin Pathol. 2020; 153:725–33.
- Yao XH, Li TY, He ZC, Ping YF, Liu HW, Yu SC. et al. A pathological report of three COVID-19 cases by minimally invasive autopsies. Zhonghua Bing Li Xue Za Zhi. 2020;49:E009.
- Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020;8:420–2.
- Ng DL, Al Hosani F, Keating MK, Gerber SI, Jones TL, Metcalfe MG, et al. Clinicopathologic, immunohistochemical, and ultrastructural findings of a fatal case of Middle East respiratory syndrome coronavirus infection in the United Arab Emirates, April 2014. Am J Pathol. 2016;186:652–8.
- Hwang DM, Chamberlain DW, Poutanen SM, Low DE, Asa SL, Butany J. Pulmonary pathology of severe acute respiratory syndrome in Toronto. Mod Pathol. 2005;18:1–10.
- Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844–7.
- Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;18:1094–9.
- Thachil J. The versatile heparin in COVID-19. J Thromb Haemost. 2020;18:1020–2.
- Ramos-Casals M, Brito-Zeron P, Lopez-Guillermo A, Khamashta MA, Bosch X. Adult haemophagocytic syndrome. Lancet. 2014; 383:1503–16.
- Karakike E, Giamarellos-Bourboulis EJ. Macrophage activationlike syndrome: a distinct entity leading to early death in sepsis. Front Immunol. 2019;10:55.
- McGonagle D, Sharif K, O’Regan A, Bridgewood C. The role of cytokines including interleukin-6 in COVID-19 induced pneumonia and macrophage activation syndrome-like disease. Autoimmun Rev. 2020;19:6. https://doi.org/10.1016/j.autrev.2020.102537.
- Henter JI, Horne A, Arico M, Egeler RM, Filipovich AH, Imashuku S, et al. HLH-2004: diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer. 2007;48:124–31.
- La Rosee P, Horne A, Hines M, von Bahr Greenwood T, Machowicz R, Berliner N, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults. Blood. 2019;133:2465–77.
- Strauss R, Neureiter D, Westenburger B, Wehler M, Kirchner T, Hahn EG. Multifactorial risk analysis of bone marrow histiocytic hyperplasia with hemophagocytosis in critically ill medical patients–a postmortem clinicopathologic analysis. Crit Care Med. 2004;32:1316–21.
- Bergsten E, Horne A, Arico M, Astigarraga I, Egeler RM, Filipovich AH, et al. Confirmed efficacy of etoposide and dexamethasone in HLH treatment: long-term results of the cooperative HLH-2004 study. Blood. 2017;130:2728–38.