Диабет и COVID-19: фактические данные, текущее состояние и оставшиеся без ответа вопросы исследования

Оригинал: Diabetes and COVID-19: evidence, current status and unanswered research questions
Автор: Ritesh Gupta et al.
Опубликовано: European Journal of Clinical Nutrition 13.05.2020
Перевод: Анна Шестакова, Фонд профилактики рака
Аннотация
Пациенты с диабетом, которые заболевают коронавирусной инфекцией 2019 года (COVID-19), подвержены риску тяжелого течения заболевания и высокой летальности. Несколько факторов, особенно нарушение иммунного ответа, усиленная воспалительная реакция и состояние гиперкоагуляции, способствуют увеличению тяжести заболевания. Тем не менее, есть много спорных вопросов, по которым доказательства довольно ограничены. Есть некоторые теоретические опасения по поводу воздействия различных антигипергликемических препаратов. Также, несмотря на признание ангиотензинпревращающего фермента 2 (АПФ2) в качестве рецептора для коронавируса тяжелого острого респираторного синдрома –– 2 (SARS CoV-2), а также понимани роли АПФ2 в повреждении легких, есть противоречивые результаты при использовании ингибиторов АПФ и блокаторов рецепторов ангиотензина (БРА) у этих пациентов. Ведение пациентов с диабетом во время ограничения передвижений выявляет некоторые проблемы, и могут быть полезны новые подходы, такие как телемедицина. Необходимо дополнительно изучить естественное течение COVID-19 у пациентов с диабетом и понять индивидуальные, региональные и этнические различия в распространенности и течении заболевания.
Почему пациенты с диабетом имеют более тяжелое течение COVID-19 и более высокую летальность?
Пациенты с диабетом, у которых развивается COVID-19, имеют худший прогноз и повышенную летальность в большинстве исследований. У 201 китайского пациента с диабетом было зарегистрировано соотношение рисков 2,34 (доверительный интервал [ДИ] 95 %, 1,35–4,05; р = 0,002) при остром респираторном дистресс-синдроме (ОРДС) [2]. Кроме того, метаанализ девяти исследований из Китая (n = 1936) показал значительную корреляцию между тяжестью COVID-19 и диабетом (отношение шансов [ОШ] 2,67, 95 % ДИ; 1,91–3,74; р < 0,01) [3]. Аналогичным образом, показатель летальности составил 7,3 % у пациентов с диабетом по сравнению с 2,3 % у пациентов без диабета в отчете о 44 672 пациентах с COVID-19 в Китайском центре контроля заболеваний [4]. Недавнее исследование с участием 1122 пациентов с COVID-19 в 88 центрах в США показало, что диабет связан с более чем четырехкратным увеличением летальности [5].
Неясно, как диабет увеличивает серьезность COVID-19, хотя некоторые факторы могут быть ответственны за это (таблица 1). Плохой контроль гликемии нарушает некоторые функции врожденного и адаптивного иммунного ответа на вирусные инфекции и способствует присоединению вторичной бактериальной инфекции в легких [6, 7]. Дефекты в иммунитете, а именно некорректное действие Т-клеток, нарушение активности естественных клеток-киллеров и отклонения в действии комплемента, могут уменьшать выведение вируса [8]. Интересно, что ОРДС у пациентов с COVID-19 обусловлен тяжелой гипоксемией, несмотря на относительно хорошо сохранившуюся легочную механику. Предшествующее провоспалительное состояние может усиливать цитокиновый шторм, который, как полагают, ответственен за ОРДС, а также за дисфункцию многих органов при COVID-19 [9]. В этом контексте важно отметить, что существует тесная связь между диабетом 2-го типа, ожирением и аномальной секрецией адипокинов и цитокинов, таких как TNF-альфа и интерферон, которые могут дополнительно нарушать функции иммунитета и провоцировать тяжелое течение инфекции [10]. Кроме того, диабет связан с повышенным уровнем плазминогена, который, как было установлено, увеличивает вирулентность SARS CoV-2 [11]. Наличие этих воспалительных и протромботических факторов было показано в исследовании на 174 пациентах, госпитализированных с COVID-19 в Ухане, Китай. Значительно более высокие уровни сывороточного интерлейкина-6, скорости оседания эритроцитов, C-реактивного белка, ферритина, фибриногена и D-димера были зарегистрированы у пациентов с диабетом по сравнению с пациентами без диабета [12]. Повышенная репликация вируса при диабете также может быть вызвана увеличением количества фурина, который является мембраносвязанной протеазой типа 1, участвующей в проникновении коронавирусов в клетку [13]. Кроме того, ранее возникшие сопутствующие заболевания, связанные с диабетом, такие как гипертония, ишемическая болезнь сердца и хроническая болезнь почек, еще более ухудшают прогноз. Наконец, гипогликемия, которая может возникнуть во время лечения диабета, может дополнительно ухудшить клинические результаты.
В этом отношении вызывает интерес роль рецептора ангиотензинпревращающего фермента 2 (АПФ2) в патогенезе COVID-19 у пациентов с диабетом. SARS CoV-2 проникает в клетку, связываясь с АПФ2. Это многостадийный процесс, который включает в себя несколько ферментов и белков [14]. Существуют экспериментальные данные о снижении АПФ2 при диабете [15], что может приводить к более тяжелому повреждению легких. С другой стороны, АПФ2 является рецептором SARS CoV-2, и снижение количества рецепторов может уменьшить проникновение вируса в клетки. Эти вопросы дополнительно обсуждаются ниже в контексте использования антигипергликемических и антигипертензивных препаратов.
Таблица 1. Причины более тяжелого течения COVID-19 при диабете, основанные на различных исследованиях (в основном, нескорректированные данные анализов).
Антигипергликемические препараты: правильный выбор и возможные проблемы
Точный эффект от терапии различными пероральными антигипергликемическими перпаратами на тяжесть COVID-19 неизвестен, хотя есть некоторые теоретические соображения. Метформин продемонстрировал незначительные преимущества при инфекциях нижних дыхательных путей и туберкулезе легких [16], хотя желудочно-кишечная переносимость у таких пациентов вызывает беспокойство. Было показано, что тиазолидиндионы увеличивают уровень АПФ2 [17]. Однако склонность тиазолидиндионов вызывать задержку жидкости и увеличивать риск застойной сердечной недостаточности при COVID-19, делает эти препараты неблагоприятными для лечения. Отмечено, что агонисты глюкагоноподобного пептида-1 увеличивают АПФ2 и увеличивают содержание сурфактанта у экспериментальных животных [18]. Практическая значимость изменений уровней АПФ2 с использованием тиазолидиндионов и агонистов глюкагоноподобного пептида-1 не известна. Препараты сульфонилмочевины эффективны, но риск гипогликемии, особенно в условиях нерегулярного приема пищи, может помешать их использованию. Тем не менее, препараты сульфонилмочевины могут рассматриваться, когда возможен мониторинг уровня глюкозы в крови.
Есть некоторые данные относительно использования ингибиторов дипептидилпептидазы 4 (ДПП-4), полученные при предшествующих вирусных эпидемиях. ДПП-4 является основным рецептором для коронавируса ближневосточного респираторного синдрома, который ответственен за проникновение вируса в клетку [19]. Следовательно, нельзя исключать возможность, что ДПП-4 облегчает проникновение SARS CoV-2 в клетку. В этом контексте интересно утверждение о том, что широкое использование ингибиторов ДПП-4 в Индии и многих других странах может защищать людей с диабетом от этой инфекции. С другой стороны, ингибиторы ДПП-4 могут потенциально влиять на иммунный ответ, который может быть опасным, но клинические данные от ингибиторов ДПП-4 показали, что это, как правило, не так [20].
В Индии и во всем мире все шире используются ингибиторы натрийзависимого котранспортера глюкозы 2-го типа (SGLT-2). Интересно, что ингибиторы SGLT-2 могут также косвенно активировать АПФ2, особенно если они используются вместе с ингибиторами АПФ [21]. Существует вероятность того, что ингибиторы SGLT-2 понижают выработку лактата из-за уменьшения потребности тканей в кислороде, а это может снижать проникновение вируса за счет повышения цитозольного pH [22]. Кроме того, при использовании ингибиторов SGLT-2 у больных пациентов с COVID-19 следует соблюдать осторожность в отношении дегидратации и возможности возникновения эугликемического кетоацидоза. Также было показано, что инсулин увеличивает экспрессию АПФ2, ослабляя действие дезинтегрина и металлопротеазы (ADAM-17) [23]. Практическая значимость этих результатов в настоящее время неизвестна. В любом случае инсулин остается средством выбора для контроля сахара у госпитализированных пациентов с COVID-19. Это, однако, требует частого мониторинга уровня глюкозы в крови и создает некоторые практические проблемы с точки зрения увеличения контактов медицинского работника и пациента с COVID-19. В этом контексте стоит рассмотреть такие стратегии, как разовая доза базального инсулина и самоконтроль глюкозы пациентами. Кроме того, такие технологии, как дистанционный мониторинг уровня глюкозы и инсулиновая помпа, могут быть полезны.
Таким образом, кажется безопасным продолжать прием обычных антигипергликемических препаратов у большинства пациентов с легкой инфекцией, хорошим общим состоянием и нормальным пероральным приемом. Однако, может потребоваться прекращение ингибиторов SGLT-2 из-за риска дегидратации и эугликемического кетоацидоза. Может также потребоваться прекращение метформина, в случае рвоты или плохого перорального потребления. Дозы других антигипергликемических препаратов, таких как сульфонилмочевины и инсулина, могут быть изменены в зависимости от уровня глюкозы в крови. Госпитализированные пациенты, особенно те, которым необходима интенсивная терапия, нуждаются в инсулине для контроля гликемии.
Препараты для лечения сопутствующих заболеваний при диабете
Ингибиторы ангиотензинпревращающего фермента (АПФ)/блокаторы рецепторов ангиотензина (БРА)
Это широко используемые препараты у пациентов с диабетом, особенно у пациентов с гипертонией и почечной дисфункцией. Было много литературы и споров, могут ли эти препараты принести пользу или вред пациентам с инфекцией COVID-19. Эта проблема обсуждается ниже.
Научные экспериментальные данные, подтверждающие потенциальный вред комбинации ингибиторов АПФ/БРА при COVID-19
Интерес к ингибиторам АПФ и БРА возник после идентификации АПФ2 в качестве рецептора для SARS CoV-2. Повышенная экспрессия АПФ2 может теоретически увеличить связывание вируса и проникновение в клетку, хотя нет клинических данных, подтверждающих каким-либо образом эту привлекательную гипотезу. Снижение ангиотензина 2 в результате ингибирования АПФ и увеличение ангиотензина 1–7 в результате повышения активности АПФ2 может снизить цитозольный рН, что может привести к созданию более благоприятной среды для вирусного эндоцитоза [24]. Кроме того, было показано, что ангиотензин 1–7 увеличивает симпатическую активность, воздействуя на рецепторы Mas в стволе мозга, что может способствовать сердечно-сосудистой заболеваемости, наблюдаемой у этих пациентов [25]. Тем не менее, большинство из этих проблем являются гипотетическими с минимальными доказательствами.
Научные экспериментальные данные, которые подтверждают пользу от ингибиторов АПФ/БРА при COVID-19
Увеличение АПФ2 может не приводить к увеличению проникновения вируса из-за ограниченной доступности сериновой протеазы TMPRSS2, которая необходима для связывания вируса [20]. Повышенный АПФ2 и, следовательно, ангиотензин 1–7 оказывают сосудорасширяющее и антифибротическое действие и, как было показано, защищают от повреждения легких у животных [26]. Сообщалось, что лечение БРА снижает летальность при инфицировании вирусом Эбола [27]. Ранее небольшое исследование на десяти пациентах с ОРДС показало, что рекомбинантный АПФ2 хорошо переносится и приводит к повышению уровня ангиотензина (1–7) [28].
Клинические исследования с ингибиторами АПФ/БРА при COVID-19
(1) Нет контролируемых исследований по применению ингибиторов АПФ и БРА у пациентов с COVID-19.
(2) Клинические данные неубедительны. В то время как одно исследование в Китае не выявило какой-либо связи между использованием ингибиторов АПФ и тяжестью заболевания, в другом исследовании отмечалась повышенная смертность у пациентов с COVID-19, получавших ингибиторы АПФ и БРА [29, 30]. Одно исследование в США не обнаружило каких-либо существенных различий летальности у пациентов, получавших ингибиторы АПФ и БРА, и у тех, кто этого не делал [31]. Недавно опубликованное исследование 1128 пациентов, госпитализированных с COVID-19 в девяти больницах в провинции Хубэй, Китай, показало значительное снижение летальности от всех причин при использовании ингибиторов АПФ или БРА по сравнению с другими антигипертензивными препаратами [32].
(3) Многие пациенты с COVID-19 показали гипокалиемию, указывающую на активацию RAS [33], и ингибиторы АПФ и БРА могут играть роль в ее возникновении [34].
В данном случае ситуация не ясна, и существует слишком много неизвестных факторов, которые могли бы действовать при взаимодействии между АПФ2, диабетом, ингибиторами АПФ/БРА и повреждением легких. Отсутствие данных о пользе или вреде побудило Европейский совет кардиологов по гипертонии, Европейское общество гипертонии и Американскую кардиологическую ассоциацию рекомендовать продолжать применение ингибиторов АПФ и БРА в случае развития у пациента COVID-19 [35]. В настоящее время проводится клиническое испытание для изучения БРА лозартана и рекомбинантного АПФ2 человека у пациентов с COVID-19.
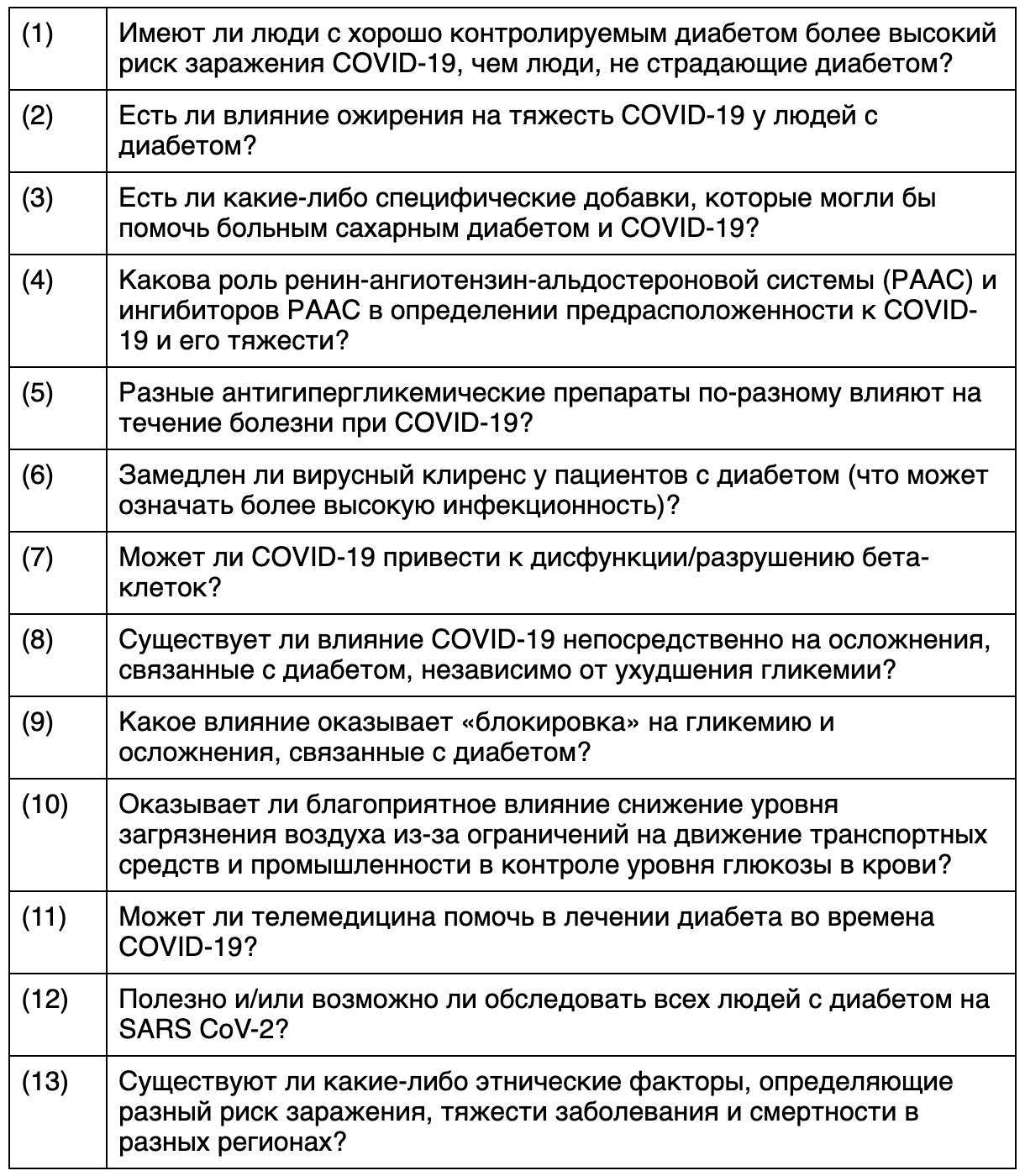
Таблица 2. Спорные вопросы и вопросы без ответа, касающиеся диабета и COVID-19.
Ссылки
- Yang J, Zheng Y, Gou X, Pu K, Chen Z, Guo Q, et al. Prevalence of comorbidities in the novel Wuhan coronavirus (COVID-19) infection: a systematic review and meta-analysis. Int J Infect Dis. 2020. pii: S1201-9712(20)30136-3. https://doi.org/10.1016/j.ijid. 2020.03.017.
- WuC, ChenX, CaiY, XiaJ, Zhou X, Xu S,et al. Risk Factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med. 2020. https://doi.org/10.1001/jama internmed.2020.0994.
- Chen Y, Gong X, Guo J. Effects of hypertension, diabetes and coronary heart disease on COVID-19 diseases severity: a systematic review and meta-analysis. 2020. https://www.medrxiv.org/content/10.1101/2020.03.25.20043133v1.
- Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA. 2020. https:// doi.org/10.1001/jama.2020.2648.
- Bode B, Garrett V, Messler J, McFarland R, Crowe J, Booth R, et al. Glycemic characteristics and clinical outcomes of COVID- 19 patients hospitalized in the United States. J Diabetes Sci Technol. 2020. doi.org.
- Carey IM, Critchley JA, DeWilde S, Harris T, Hosking FJ, Cook DG. Glycemic control and risk of infections among people with type 1 or type 2 diabetes in a large primary care cohort study. Diabetes Care 2018;41:513–21. https://doi.org/10.2337/dc17-2131.
- Ferlita S, Yegiazaryan A, Noori N, Lal G, Nguyen T, To K, et al. Type 2 diabetes mellitus and altered immune system leading to susceptibility to pathogens, especially mycobacterium tuberculosis. J Clin Med. 2019;8:2219. https://doi.org/10.3390/ jcm8122219.
- Nyambuya TM, Dludla PV, Mxinwa V, Nkambule BB. T-cell activation and cardiovascular risk in adults with type 2 diabetes mellitus: A systematic review and meta-analysis. Clin Immunol. 2020;210:108313. doi.org.
- Maddaloni E, Buzzetti R. Covid-19 and diabetes mellitus: unveiling the interaction of two pandemics. Diabetes Metab Res Rev. 2020:e33213321. doi.org.
- Huttunen R, Syrjänen J. Obesity and the risk and outcome of infection. Int J Obes. 2013;37:333–40.
- Ji HL, Zhao R, Matalon S, Matthay MA. Elevated Plasmin(ogen) as a common risk factor for COVID-19 susceptibility. Physiol Rev. 2020;100:1065–75. https://doi.org/10.1152/physrev.00013. 2020.
- Guo W, Li M, Dong Y, Zhou H, Zhang Z, Tian C, et al. Diabetes is a risk factor for the progression and prognosis of COVID‐19. Diabetes Metab Res Rev. 2020:e3319. https://doi.org/10.1002/ dmrr.3319.
- Fernandez C, Rysa J, Almgren P, Nilsson J, Engström G, Orho- Melander M, et al. Plasma levels of the proprotein convertase furin and incidence of diabetes and mortality. J Intern Med. 2018;284:377–87. doi.org.
- Hoffmann M, Kleine-Weber H, Krüger N, Müller M, Drosten C, Pöhlmann S. The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular protease TMPRSS2 for entry into target cells. 2020. https://doi.org/10. 1101/2020.01.31.929042.
- Li XC, Zhang J, Zhuo JL. The vasoprotective axes of the renin- angiotensin system:physiological relevance and therapeutic implications in cardiovascular, hypertensive and kidney diseases. Pharm Res. 2017;125:21–38.
- Mendy A, Gopal R, Alcorn JF, Forno E. Reduced mortality from lower respiratory tract disease in adult diabetic patients treated with metformin. Respirology. 2019;24:646–51.
- Zhang W, Xu YZ, Liu B, Wu R, Yang YY, Xiao XQ, et al. Pioglitazone upregulates angiotensin converting enzyme 2 expression in insulin-sensitive tissues in rats with high-fat diet- induced nonalcoholic steatohepatitis. Sci World J. 2014:603409. doi.org.
- Romaní-Pérez M, Outeiriño-Iglesias V, Moya CM, Santisteban P, González-Matías LC, Vigo E, et al. Activation of the GLP-1 receptor by liraglutide increases ACE2 expression, reversing right ventricle hypertrophy, and improving the production of SP-A and SP-B in the lungs of type 1 diabetes rats. Endocrinology. 2015;156:3559–69.
- Arabi YM, Balkhy HH, Hayden FG, Bouchama A, Luke T, Baillie JK, et al. Middle east respiratory syndrome. N Engl J Med. 2017;376:584–94. doi.org.
- Yang W, Cai X, Han X, Ji L. DPP-4 inhibitors and risk of infections: a meta-analysis of randomized controlled trials. Diabetes Metab Res Rev. 2016;32:391–404. https://doi.org/10.1002/dmrr.2723.
- Filippatos TD, Liontos A, Papakitsou I, Elisaf MS. SGLT2 inhibitors cardioprotection: a matter debate and multiple hypotheses. Postgrad Med. 2019;131:82–88. https://doi.org/10.1080/00325481.2019.1581971.
- Couselo-Seijas M, Agra-Bermejo RM, Fernández AL, Martínez- Cereijo JM, Sierra J, Soto-Pérez M. High released lactate by epicardial fat from coronary artery disease patients is reduced by dapagliflozin treatment. Atherosclerosis. 2020;292:60–69. https://doi.org/10.1016/j.atherosclerosis.2019.11.016.
- Salem ESB, Grobe N, Elased KM. Insulin treatment attenuates renal ADAM17 and ACE2 shedding in diabetic Akita mice. Am J Physiol-Ren Physiol. 2014;306:F629–39.
- Cure E, Cumhur Cure M. Comment on “organ-protective effect of angiotensin-converting Enzyme 2 and its effect on the prognosis of COVID-19”. J Med Virol. 2020. https://doi.org/10.1002/jmv.25848.
- Bilodeau MS, Leiter JC. Angiotensin 1-7 in the rostro ventrolateral medulla increases blood pressure and splanchnic sympathetic nerve activity in anesthetized rats. Respir Physiol Neurobiol. 2018;247:103–11.
- Yang P, Gu H, Zhao Z, Wang W, Cao B, Lai C, et al. Angiotensin converting enzyme 2 (ACE2) mediates influenza H7N9 virus- induced acute lung injury. Sci Rep. 2014;4:7027.
- Fedson DS, Jacobson JR, Rordam OM, Opal SM. Treating the host response to Ebola virus disease with generic statins and angiotensin receptor blockers. mBio. 2015;6:e00716. https://doi. org/10.1128/mBio.00716-15.
- Khan A, Benthin C, Zeno B, Albertson TJ, Boyd J, Christie JD, et al. A pilot clinical trial of recombinant human angiotensin converting enzyme 2 in acute respiratory distress syndrome. Crit Care. 2017;21:234.
- Peng YD, Meng K, Guan HQ, Leng L, Zhu RR, Wang BY, et al. Clinical characteristics and outcomes of 112 cardiovascular disease patients infected by 2019-nCoV. Zhonghua Xin Xue Guan Bing Za Zhi. 2020;48:E004. https://doi.org/10.3760/cma.j.cn112148-20200220-00105.
- Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, et al. Cardiovascular Implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19). JAMA Cardiol. 2020;27: e201017. doi.org.
- Richardson S, Hirsch JS, Narasimhan M, Crawford JM, McGinn T, Davidson KW, et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA. 2020. https://doi.org/10.1001/jama.2020.6775.
- Zhang, Zhu L, Cai L, Lei F, et al. Association of inpatient use of angiotensin converting enzyme inhibitors and angiotensin ii receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. Circ Res. 2020. https://doi.org/10.1161/CIRCRESAHA.120.317134.
- Chen D, Li X, Song Q, Hu C, Su F, Dai J, et al. Hypokalemia and clinical implications in patients with coronavirus disease 2019 (COVID-19). 2020. https://doi.org/10.1101/2020.02.27.20028530.
- Zhang, Zhu L, Cai L, Lei F, Qin JJ, Xie J, et al. Association of inpatient use of angiotensin converting enzyme inhibitors and angiotensin ii receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. Circ Res. 2020. doi.org.
- Gupta R, Misra A. Contentious issues and evolving concepts in the clinical presentation and management of patients with COVID-19 infection with reference to use of therapeutic and other drugs used in Co-morbid diseases (Hypertension, diabetes etc). Diabetes Metab Syndr. 2020;14:251–4. https://doi.org/10.1016/j. dsx.2020.03.012.
- Hussain A, Bhowmik B, do Vale Moreira NC. COVID-19 and diabetes: knowledge in progress. Diabetes Res Clin Pract. 2020:108142. doi.org.
- HanY,JiangM,XiaD,HeL,LvX,LiaoX,etal.COVID-19ina patient with long-term use of glucocorticoids: A study of a familial cluster. Clin Immunol. 2020;214:108413. https://doi.org/ 10.1016/j.clim.2020.108413.
- Singh AK, Singh A, Shaikh A, Singh R, Misra A. Chloroquine and hydroxychloroquine in the treatment of COVID-19 with or without diabetes: a systematic search and a narrative review with a special reference to India and other developing countries. Diabetes Metab Syndr. 2020;14:241–6. https://doi.org/10.1016/j.dsx.2020. 03.011.39. Yang JK, Lin SS, Ji XJ, Guo LM. Binding of SARS coronavirus to its receptor damages islets and causes acute diabetes. Acta Diabetol. 2010;47:193–9. doi.org.
- Zhang SX, Wang Y, Rauch A, Wei F. Unprecedented disruption of lives and work: health, distress and life satisfaction of working adults in China one month into the COVID-19 outbreak. Psychiatry Res. 2020;288:112958. https://doi.org/10.1016/j.psychres. 2020.112958.
- Ghosal S, Sinha B, Majumder M, Misra A. Estimation of effects of nationwide lockdown for containing coronavirus infection on worsening of glycosylated haemoglobin and increase in diabetes- related complications: a simulation model using multivariate regression analysis. Diabetes Metab Syndr. 2020;14:319–23. doi.org.
- Ghosh A, Gupta R, Misra A. Telemedicine for diabetes care in India during COVID19 pandemic and national lockdown period: guidelines for physicians. Diabetes Metab Syndr. 2020;14:273–6. doi.org.
- Gupta R, Ghosh A, Singh AK, Misra A. Clinical considerations for patients with diabetes in times of COVID-19 epidemic. Diabetes Metab Syndr. 2020;14:211–2. https://doi.org/10.1016/j.dsx. 2020.03.002.
- APM Research Lab. The color of coronavirus, COVID-19 deaths by race and ethnicity in the U.S. APM Research Lab; 2020. apmresearchlab.org.
- Delanghe JR, Speeckaert MM, De Buyzere ML. The host’s angiotensin-converting enzyme polymorphism may explain epidemiological findings in COVID-19 infections. Clin Chim Acta. 2020;505:192–3. doi.org.
- Dutheil F, Baker JS, Navel V. COVID-19 as a factor influencing air pollution? Environ Pollut. 2020;263:114466. https://doi.org/ 10.1016/j.envpol.2020.114466.
- Yang BY, Fan S, Thiering E, Seissler J, Nowak D, Dong GH. et al. Ambientair pollution and diabetes: a systematic review and meta-analysis. Environ Res. 2020;180:108817. https://doi.org/10. 1016/j.envres.2019.108817.