Человеческие моноклональные антитела блокируют связывание шиповидного белка SARS-CoV-2 с ангиотензинпревращающим ферментом 2
Авторы: Xiangyu Chen et al.
Перевод: Евгения Фрей
В настоящее время нет ни одобренных профилактических вакцин, ни препаратов для специфической терапии COVID‑19. Блокирующие моноклональные антитела (МкАТ), благодаря их уникальной специфичности к антигену, являются перспективным средством для борьбы с вирусной инфекцией (10, 11). Выделение и клонирование блокирующих МкАТ, способных специфически связываться с поверхностными вирусными белками и блокировать проникновение вируса в клетку, — многообещающий метод профилактики и лечения COVID‑19, в особенности в условиях текущей пандемии, когда эффективные вакцины или специфические препараты отсутствуют. Цель данной работы — идентификация и клонирование блокирующих МкАТ, способных предотвратить слияние вируса SARS‑CoV‑2с клетками-хозяевами, из репертуара В-клеток иммунной памяти пациентов, недавно перенёсших COVID‑19.
Вирусы SARS‑CoV и SARS‑CoV‑2 используют высоко гликозилированный гомотримерный шиповидный белок S для связывания со специфическим рецептором, что позволяет вирусу проникнуть внутрь клетки-хозяина (3, 12–15). Белок S вируса SARS‑CoV‑2 состоит из двух субъединиц, S1 и S2. Специфическим рецептором для вирусов SARS‑CoV и SARS‑CoV‑2 является ангиотензипревращающий фермент 2 (АПФ2). Чтобы связаться с рецептором, белок S претерпевает значительные конформационные изменения. Как следствие, экспонируется рецептор-связывающий домен (РСД) и ключевые аминокислотные остатки, непосредственно обеспечивающие связывание с рецептором. Белок S находится в метастабильном состоянии, и связывание РСД с АПФ2, вероятно, приводит к отделению субъединиц S1 и S2 друг от друга. В результате происходит опосредованное субъединицей S2 слияние вируса с мембраной клетки-хозяина, и вирус проникает в клетку (16–18). Именно РСД делает возможным слияние вируса SARS‑CoV‑2 с клеткой и, следовательно, РСД является наиболее подходящей мишенью для нейтрализующих антител. В литературе нет данных о МкАТ, специфически блокирующих взаимодействие РСД вируса SARS‑CoV‑2 и АПФ2. Недавно было показано, что специфичные по отношению к субъединице S1 моноклональные антитела, полученные от иммунизированных трансгенных мышей, экспрессирующих вариабельные части тяжёлых и лёгких цепей человеческих Ig, нейтрализуют инфекцию SARS‑CoV и SARS‑CoV‑2. Однако механизм этого явления не связан с блокадой взаимодействия РСД‑АПФ2 и точно не охарактеризован (19).
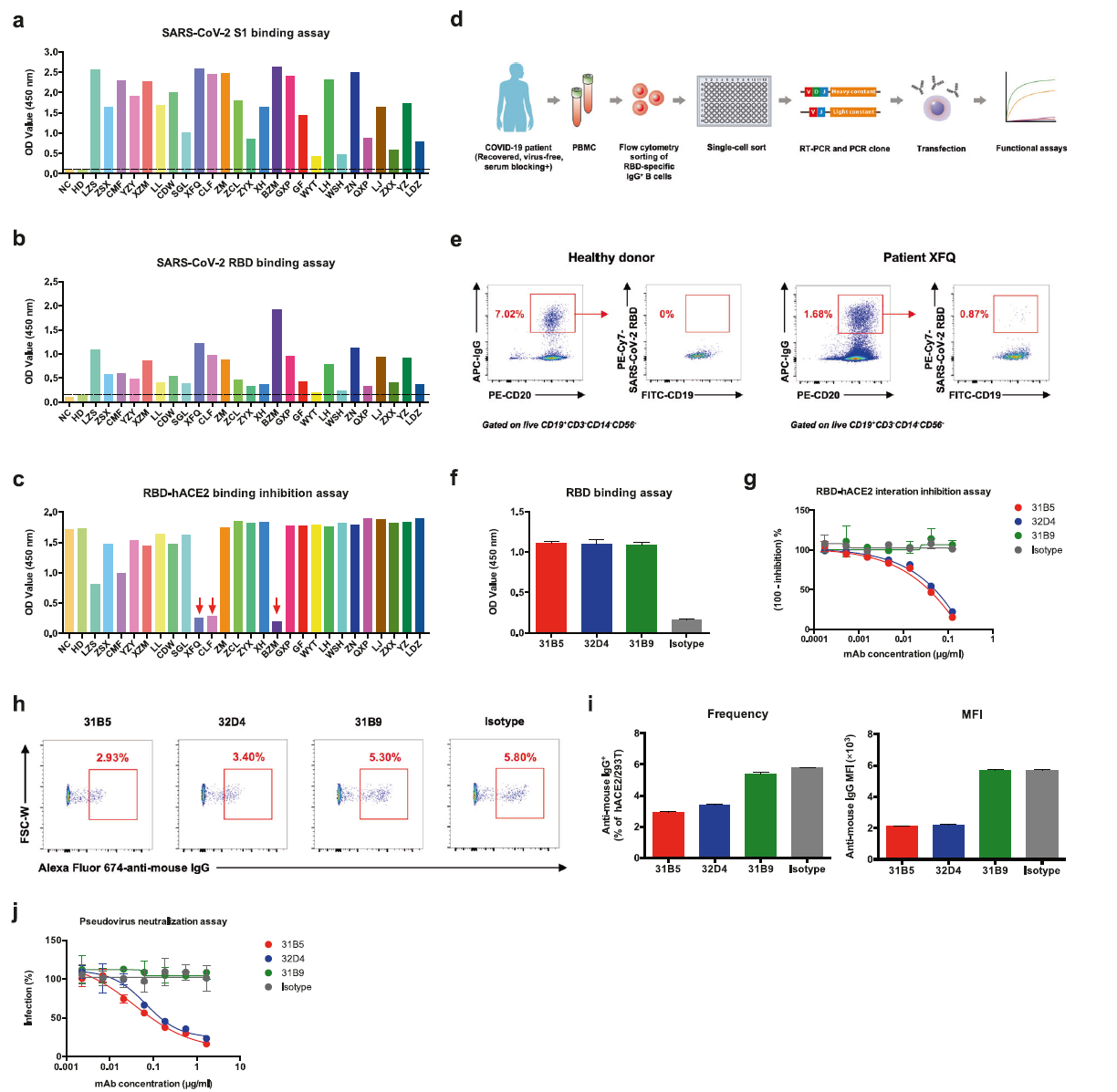
Для клонирования МкАТ использовались образцы крови трёх пациентов, недавно перенёсших COVID‑19; сыворотка, полученная из этих образцов, блокировала связывание с АПФ2. С помощью проточной цитометрии SARS‑CoV‑2 РСД‑специфичные, изотип‑переключённые IgG+ В‑клетки памяти были рассортированы в 96-луночные планшеты (сортировка единичных клеток, так что в одну лунку планшета попадает одна клетка). Для амплификации VH- и VL-кодирующих нуклеотидных последовательностей из каждой отдельной В-клетки памяти использовалась ПЦР с обратной транскрипцией. [VH — вариабельный участок тяжёлой цепи, VL — вариабельный участок лёгкой цепи]. Затем обе последовательности были вставлены в экспрессионные плазмиды, кодирующие константные участки тяжёлой и лёгкой цепей IgG1 человека (рис. 1d) (21). SARS‑CoV‑2 РСД‑специфичные IgG+ В‑клетки памяти в большом количестве обнаруживались у пациентов, перенёсших COVID‑19, но не у здоровых добровольцев из контрольной группы (рис. 1е). Это подтверждает специфичность используемого метода сортировки. В результате были получены три пары экспрессионных плазмид со встроенными VH- и VL-последовательностями IgG.
После завершения культивирования были выделены МкАТ, названные 311mab‑31B5, 311mab‑32D4 и 311mab‑31B9, соответственно. Результаты твердофазного ИФА показали, что все три МкАТ способны к прочному специфическому связыванию с РСД вируса SARS‑CoV‑2 (рис. 1f). Чтобы выяснить, могут ли полученные МкАТ блокировать взаимодействие между РСД вируса SARS‑CoV‑2 и АПФ2, были проведены соответствующие тесты. Оказалось, что 311mab‑31B5 и 311mab‑32D4 эффективно блокируют взаимодействие РСД вируса SARS‑CoV‑2 и АПФ2 (IC50 = 0,0332 и 0,0450 мкг/мл, соответственно), тогда как антитела 311mab‑31B9 не обладают таким свойством (рис. 1g). Способность антител 31B5- и 32D4 блокировать взаимодействие между РСД вируса SARS‑CoV‑2 и АПФ2 была также подтверждена методом проточной цитометрии (рис. 1h, i). Способность антител к нейтрализации вирусного антигена оценивалась при помощи лентивирусных частиц, псевдотипированных гликопротеином S вируса SARS‑CoV‑2 (22). Антитела 311mab‑31B5 и 311mab‑32D4 эффективно предотвращали слияние псевдовируса с клетками, эктопически экспрессирующими АПФ2, что согласуется с результатами твердофазного ИФА и проточной цитометрии.
Таким образом, были успешно клонированы два вида человеческих блокирующих МкАТ; для этого использовались SARS‑CoV‑2 РСД-специфичные В‑клетки памяти, выделенные от пациентов, перенёсших COVID-19. Полученные МкАТ обладают способностью специфически связываться с РСД вируса SARS‑CoV‑2, блокировать взаимодействие между РСД вируса SARS‑CoV‑2 и его рецептором, АПФ2; а также способностью нейтрализовать инфекцию, вызванную вирусом, псевдотипированным гликопротеином SARS‑CoV‑2. Моноклональные антитела, блокирующие взаимодействие между РСД вируса SARS‑CoV‑2 и АПФ2, выделены впервые. Описанные в данной статье МкАТ представляют огромный интерес, поскольку могут быть использованы для специфической профилактики и лечения COVID‑19.
Рисунок 1.
Список литературы
- World Health Organization. who.int situation-reports/20200318-sitrep-58-covid-19.pdf?sfvrsn=20876712_2. (2020).
- Wu, F. et al. A new coronavirus associated with human respiratory disease in China. Nature. 579, 265–269 (2020).
- Zhou, P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270–273 (2020).
- Zhu, N. et al. A novel coronavirus from patients with pneumonia in China, 2019. N. Engl. J. Med. 382, 727–733 (2020).
- Huang, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 395, 497–506 (2020).
- Wang, D., et al., Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA, 2020. https://doi.org/10.1001/jama.2020.1585. [Epub ahead of print].
- Yang, X., et al., Clinical course and outcomes of critically ill patients with SARSCoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med., pii: S2213-2600(20)30079-5. (2020).
- Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 395, 507–513 (2020).
- World Health Organization. https://www.who.int/dg/speeches/detail/whodirector-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020. (2020).
- Marston, H. D., Paules, C. I. & Fauci, A. S. Monoclonal antibodies for emerging infectious diseases—borrowing from history. N. Engl. J. Med. 378, 1469–1472 (2018).
- Saylor, C., Dadachova, E. & Casadevall, A. Monoclonal antibody-based therapies for microbial diseases. Vaccine 27, G38–46 (2009).
- Jun Lan, J. G., et al, Crystal structure of the 2019-nCoV spike receptor-binding domain bound with the ACE2 receptor. bioRxiv, 2020. 2020.02.19.956235; doi.org.
- Li, F. Structure, function, and evolution of coronavirus spike proteins. Annu Rev. Virol. 3, 237–261 (2016).
- Li, F. et al. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor. Science 309, 1864–8 (2005).
- Yan, R., et al., Structural basis for the recognition of the SARS-CoV-2 by full-length human ACE2. Science 367, 1444–8 (2020).
- Gui, M. et al. Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding. Cell Res. 27, 119–129 (2017).
- Kirchdoerfer, R. N. et al. Pre-fusion structure of a human coronavirus spike protein. Nature 531, 118–21 (2016).
- Wrapp, D. et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 367, 1260–1263 (2020).
- Chunyan Wang, W. L., et al, A human monoclonal antibody blocking SARS-CoV-2 infection. bioRxiv, 2020. 2020.03.11.987958; doi.org.
- Pallesen, J. et al. Immunogenicity and structures of a rationally designed prefusion MERS-CoV spike antigen. Proc. Natl Acad. Sci. USA 114, E7348–E7357 (2017).
- Smith, K. et al. Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen. Nat. Protoc. 4, 372–84 (2009).
- Xiuyuan Ou, Y. L. et al. Characterization of spike glycoprotein of 2019- nCoV on virus entry and its immune cross- reactivity with spike glycoprotein of SARS-CoV. Nat. Commun. https://doi.org/10.21203/rs.2.24016/v1 (2020).