Безопасность и иммуногенность двух вакцин-кандидатов против COVID-19 на основе РНК

Оригинал: NEJM
Автор: Edward E. Walsh et al.
Опубликовано: 14 октября 2020, NEJM
Перевод: Анна Селюта, ФГБУ НМИЦ онкологии им. Н.Н. Петрова, Фонд «Не напрасно»
Аннотация
Данные
Заболевание, вызванное коронавирусом 2 (SARS-CoV-2) — коронавирусная болезнь 2019 (COVID-19) — распространилось среди миллионов людей во всем мире. Несколько вакцин-кандидатов находятся в стадии разработки, но в настоящее время вакцины нет. Предварительные данные о безопасности и иммуногенности вакцины-кандидата BNT162b1 у молодых людей были получены ранее из испытаний в Германии и США.
Методы
В продолжающемся слепом плацебо-контролируемом исследовании (фаза 1, с эскалацией доз), проводимом в США, мы случайным образом распределили здоровых взрослых в возрасте от 18 до 55 лет и людей в возрасте от 65 до 85 лет, которые получали либо плацебо, либо одну из двух вакцин-кандидатов с липидными наночастицами, модифицированными нуклеозидом РНК (modRNA). Первая — BNT162b1 с закодированным секретируемым тримеризованным связывающим рецептором домена SARS-CoV-2. Вторая — BNT162b2 с закодированным, прикрепленным к мембране полноразмерным спайк-белком SARS-CoV-2, стабилизированным в конформации до слияния. Первичным исходом была безопасность (например, местные и системные реакции, побочные эффекты); иммуногенность была вторичным исходом. Группы испытаний были определены в соответствии с вакциной-кандидатом, возрастом участников и дозой вакцины (10 мкг, 20 мкг, 30 мкг и 100 мкг). Во всех группах, кроме одной, участники получали 2 дозы с интервалом между дозами 21 день; в одной группе (100 мкг, BNT162b1) участники получили 1 дозу.
Результаты
Всего были рандомизированы 195 участников. В каждой из 13 групп по 15 человек 12 человек получили вакцину и 3 — плацебо. BNT162b2 была связана с более низкой частотой и серьезностью развившихся системных реакций, чем BNT162b1, особенно у пожилых людей. И у молодых, и у пожилых людей 2 вакцины-кандидата вызвали аналогичные дозозависимые средние титры нейтрализации антител SARS-CoV-2, которые были аналогичны среднему титру антител на панели образцов реконвалесцентной плазмы от SARS-CoV-2 или превышали его.
Выводы
Данные по безопасности и иммуногенности фазы 1 исследования двух вакцин-кандидатов у молодых и пожилых людей в США и более ранние промежуточные данные по безопасности и иммуногенности BNT162b1 у молодых людей из испытаний в Германии и США подтверждают, что BNT162b2 можно продвигать в фазы 2-3, чтобы оценить безопасность и эффективность. (При финансовой поддержке BioNTech и Pfizer; номер исследования на ClinicalTrials.gov — NCT04368728.)
Результаты
Демографические характеристики участников
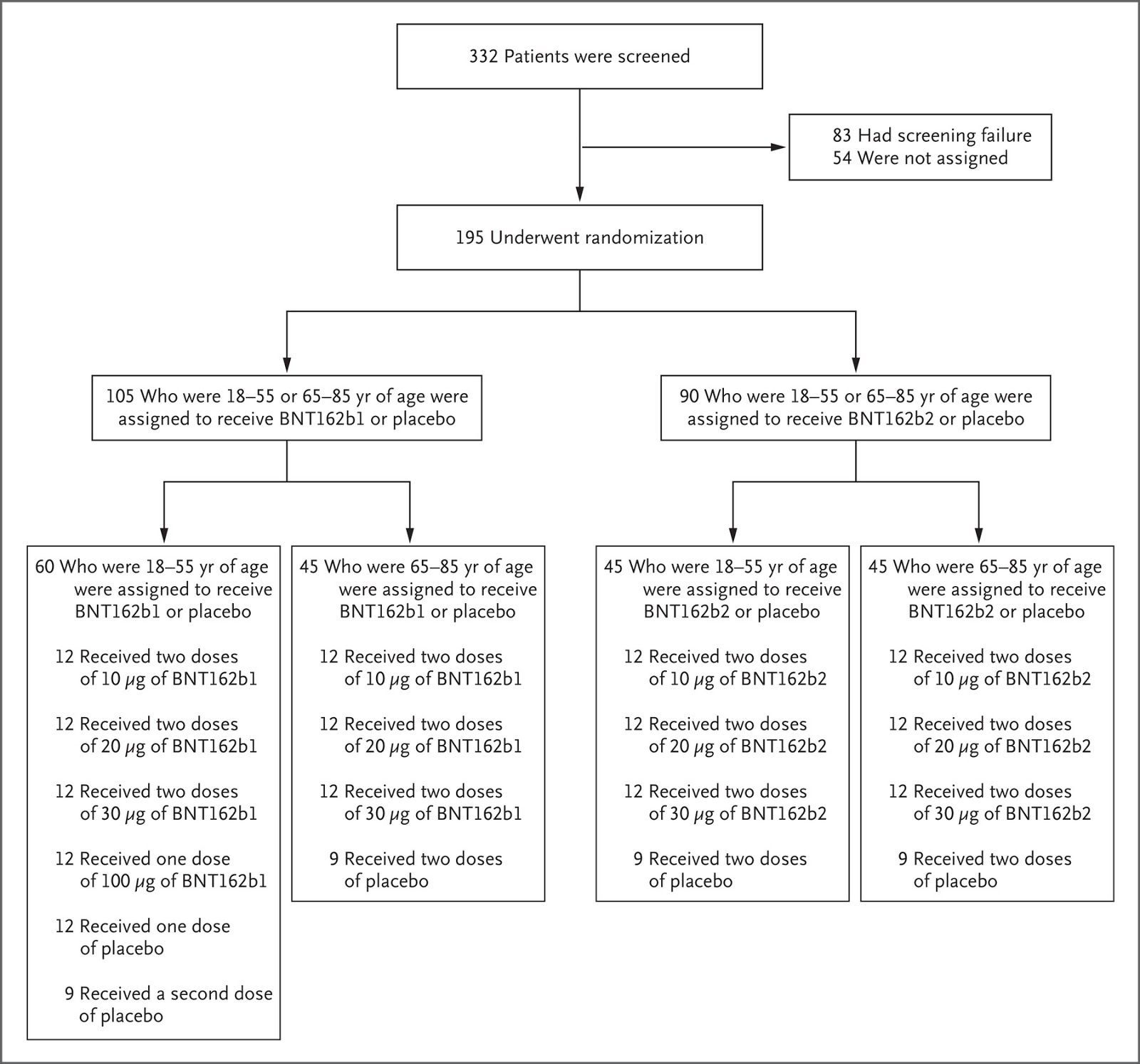
В период с 4 мая 2020 года по 22 июня 2020 года в общей сложности 332 здоровых взрослых человека (мужчины и небеременные женщины) прошли скрининг в 4 центрах в США (2 центра на каждую вакцину-кандидат). Всего 195 участников были случайным образом разделены на 13 групп по 15 человек в каждой; в каждой группе 12 участников получили вакцину и 3 — плацебо (рис. 1). Во всех группах, кроме одной, все участники, прошедшие рандомизацию, получили назначенные 2 дозы вакцины или плацебо. Участники в возрасте от 18 до 55 лет, которым были назначены 100 мкг BNT162b1 или плацебо, получили 1 дозу; вторая доза не была введена из-за реактогенности.
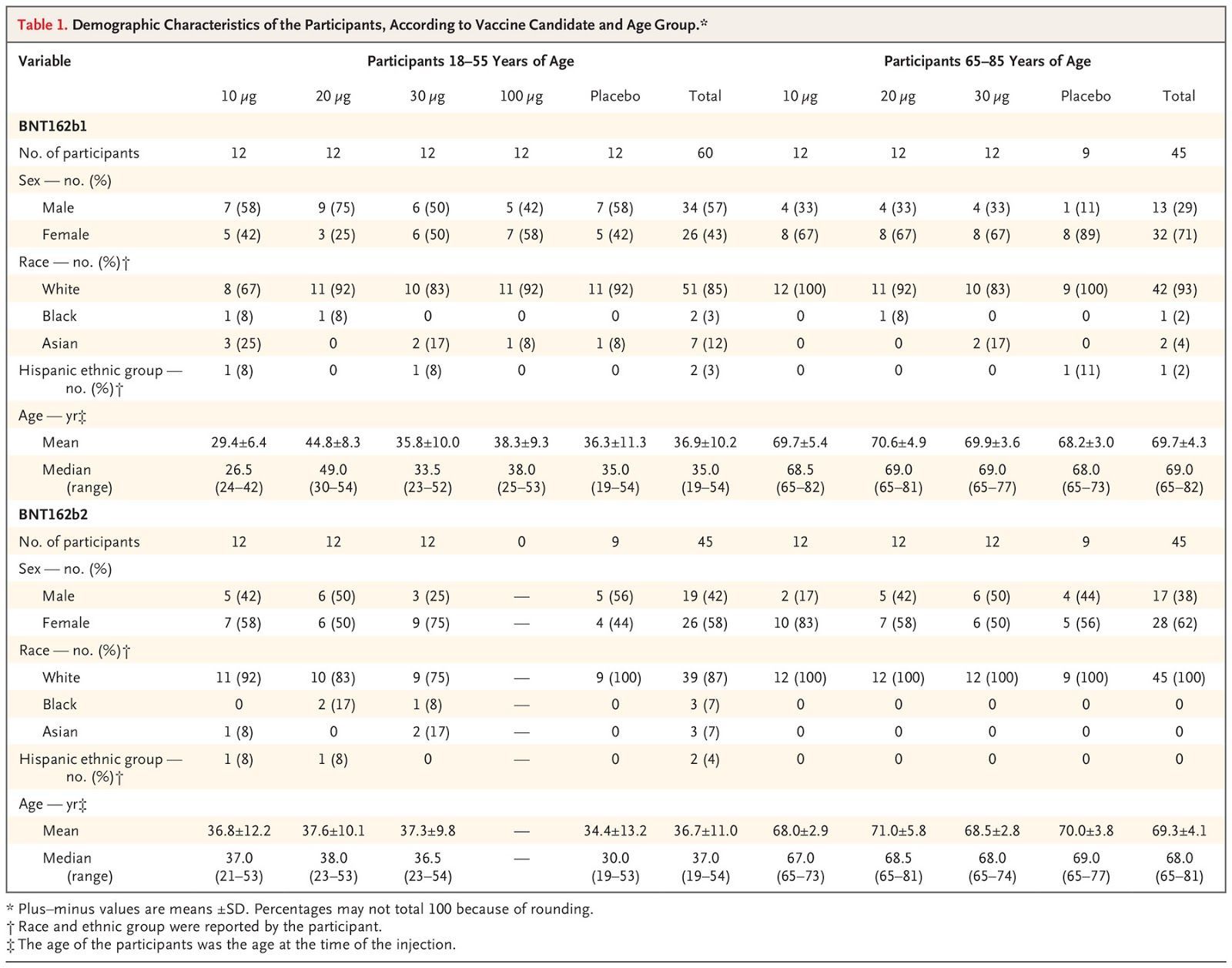
Большинство участников были европеоидной расы (от 67% до 100%) и неиспаноязычными (от 89% до 100%) (таблица 1). Участвовало больше женщин старшего возраста, чем мужчин старшего возраста. Средний возраст более молодых участников составлял 35 лет в группе BNT162b1 и 37 лет в группе BNT162b2; средний возраст старших участников составлял 69 и 68 лет соответственно.
Безопасность
Местные реакции
Участники в возрасте от 18 до 55 лет, которые получили 10 мкг, 20 мкг или 30 мкг BNT162b1, сообщали о местных реакциях легкой и средней степени тяжести, в первую очередь о боли в месте инъекции в течение 7 дней после инъекции; местные реакции чаще возникали после введения второй дозы [2,5]. BNT162b1 вызвала местные реакции у одинаковых пропорций участников в младшей и старшей возрастных группах. Среди участников старшего возраста о боли в месте инъекции от легкой до средней степени тяжести сообщили 92% участников после введения первой дозы и 75% после второй дозы (рис. 2). Аналогичная картина наблюдалась после вакцинации BNT162b2. Ни один из участников старшего возраста, получавших BNT162b2, не сообщил о покраснении или отеке. Ни один из участников, получивших вакцину BNT162, не сообщил о местной реакции 4 степени.
Системные реакции
BNT162b1
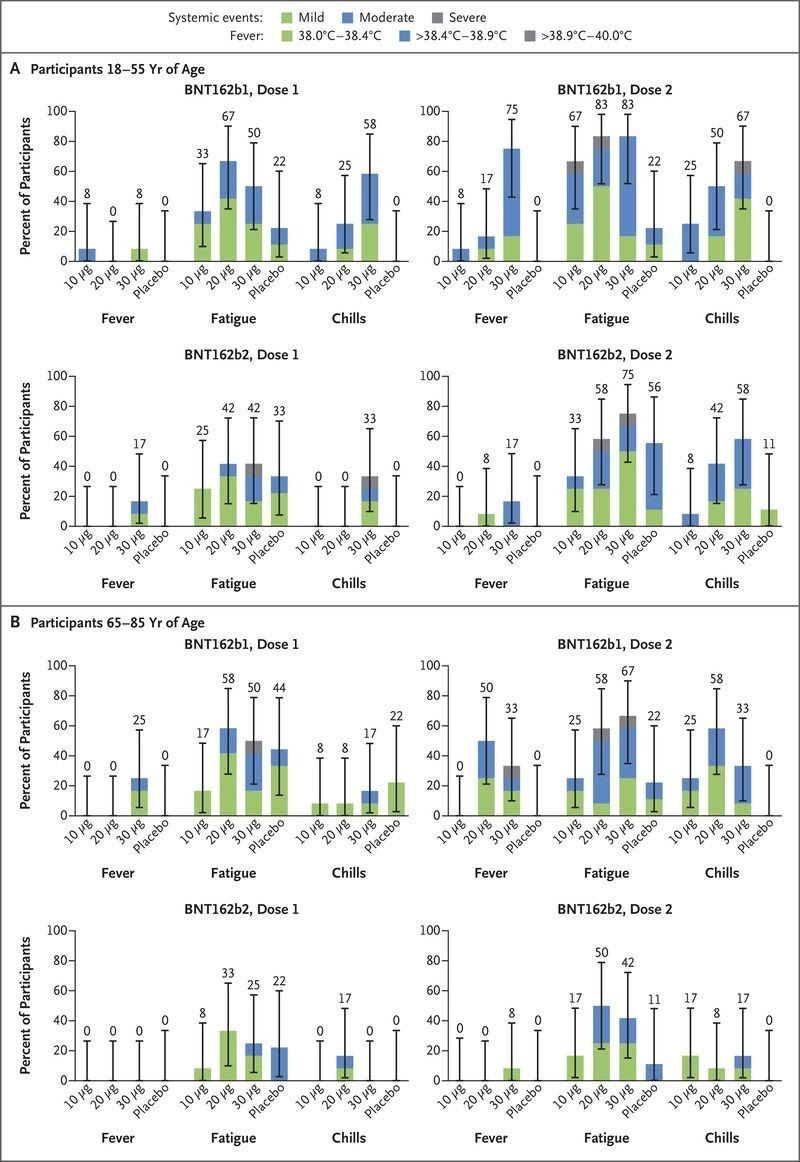
У участников исследования в возрасте от 18 до 55 лет, получивших BNT162b1 в дозе 10 мкг, 20 мкг или 30 мкг, часто наблюдались лихорадка и озноб от легкой до средней степени тяжести, при этом 75% участников сообщали о повышении температуры до 38,0 °C или выше после второй дозы в 30 мкг (рис. 3; и рис. S1 в дополнительном приложении, доступном на NEJM.org [прим. перев.: на момент перевода дополнительное приложение недоступно]) [5]. У участников в возрасте от 65 до 85 лет, получавших BNT162b1, системные реакции были более легкими, чем у более молодых участников, хотя многие участники старшего возраста сообщили о слабости и головной боли после первой или второй дозы и 33% сообщили о повышении температуры до 38 °C или выше после введения второй дозы, в том числе один пожилой участник, который сообщил о повышении температуры от 38,9 до 40,0 °C (рис. 3 и Рисунок S2). Системные реакции были преходящими и дозозависимыми (степень проявления была больше после второй дозы, чем после первой). Симптомы обычно достигали пика на 2-й день после вакцинации и исчезали к 7-му дню.
BNT162b2
Системные реакции при введении BNT162b2 были более мягкими, чем при BNT162b1 (рис. 3 и рисунки S1 и S2). Например, 17% участников в возрасте от 18 до 55 лет и 8% участников в возрасте от 65 до 85 лет сообщили о повышении температуры (от 38,0 до 38,9 °C) после введения второй дозы в 30 мкг BNT162b2. О серьезных системных реакциях (слабость, головная боль, озноб, боль в мышцах и боль в суставах) сообщило небольшое число участников в более молодой группе, получившей BNT162b2. Старшая группа, получившая BNT162b2, не сообщала о серьезных системных реакциях. Ни один участник, который получил вакцину BNT162, не сообщил о системной реакции 4 степени. После первой дозы системные реакции, о которых сообщили участники в возрасте от 65 до 85 лет, получавшие BNT162b2, были аналогичны тем, о которых сообщили участники, получавшие плацебо.
Обе вакцины
Прием жаропонижающих или обезболивающих средств возрастал с увеличением дозы и количества введенных доз в обеих возрастных группах и для обеих вакцин-кандидатов. Реципиенты BNT162b2 сообщали, что меньше использовали жаропонижающие или обезболивающие препараты в сравнении с реципиентами BNT162b1.
Нежелательные явления и сдвиги лабораторных показателей
Через 1 месяц после получения второй дозы о нежелательных явлениях, которые исследователи считали связанными с вакциной или плацебо, сообщили 50% участников в возрасте от 18 до 55 лет, получивших 30 мкг BNT162b1, по сравнению с 8% из тех, кто получал плацебо [5]. О нежелательных явлениях, которые считались связанными с вакциной, сообщили 17% участников в возрасте от 65 до 85 лет, получивших 30 мкг BNT162b1, и 25% участников от 18 до 55 лет, получивших 30 мкг BNT162b2. Ни один участник в возрасте от 65 до 85 лет, получивший 30 мкг BNT162b2, не сообщил о побочных эффектах (Таблица S1).
Участники не сообщили о серьезных побочных эффектах. На момент написания данного отчета введение вакцин не было отменено в соответствии с инструкцией. Наибольшее изменение лабораторных показателей по сравнению с исходным уровнем заключалось во временном снижении количества лимфоцитов. Оно разрешилось в течение 1 недели после вакцинации (рис. S3) и не проявлялось клинически.
Иммуногенность
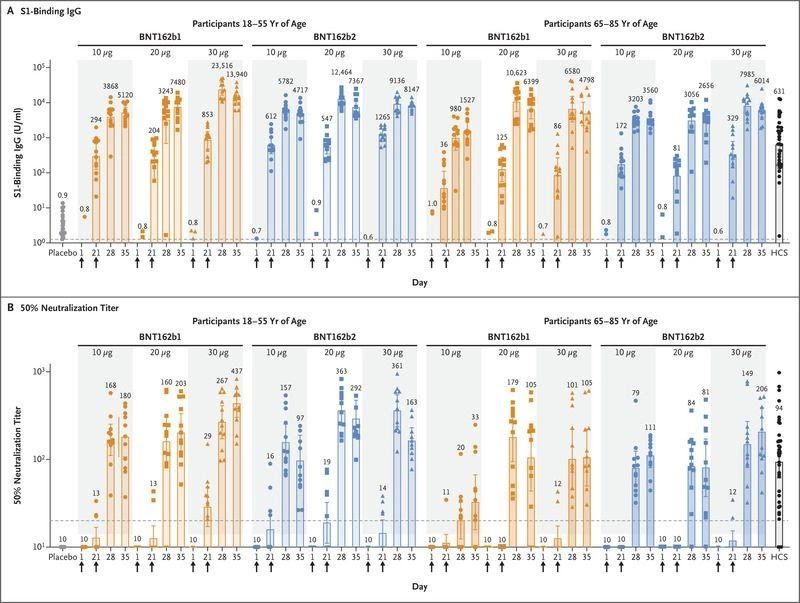
Серологические ответы, вызванные BNT162b1 и BNT162b2, были сходными (рис. 4). Два образца сыворотки, оба от группы участников в возрасте от 18 до 55 лет, которые получили 30 мкг BNT162b2, оказались вне указанных диапазонов (по одному на 28-й и 35-й день) и, таким образом, были исключены из представленного анализа иммуногенности. Антигенсвязывающий IgG и вирус-нейтрализующий ответ на вакцинацию с 10 мкг до 30 мкг BNT162b1 или BNT162b2 были усилены второй дозой как в группе молодых [2,5], так и у пожилых. Обе вакцины вызывали, как правило, более низкие антигенсвязывающие IgG и вирус-нейтрализующие ответы у участников в возрасте от 65 до 85 лет, чем у участников в возрасте от 18 до 55 лет. Более высокие дозы, по-видимому, вызывают несколько более высокий ответ антител.
Наивысшие титры нейтрализации представлены в образцах, полученных на 28 день (то есть через 7 дней после второй дозы) или на 35 день (то есть через 14 дней после второй дозы). Аналогичные тенденции наблюдались для 50% и 90% нейтрализующих титров (рис. S4). 50% нейтрализующих титров антител (GMTs) для двух вакцин-кандидатов при уровне дозы 30 мкг на 28-й или 35-й день варьировались от 1,7 до 4,6 раза по сравнению с GMT на панели реконвалесцентной плазмы среди участников в возрасте от 18 до 55 лет и от 1,1 до 2,2 раза для GMT группы реконвалесцентной плазмы среди лиц в возрасте от 65 до 85 лет. Для достоверных результатов анализа образцов, которые можно было оценить для каждой группы в каждый момент времени, стоит учитывать, что попарные сравнения подвержены ошибкам и не имеют четкой интерпретации.
Обсуждение
Ранее опубликованные данные о вакцинации BNT162b1 в дозе 10 или 30 мкг у взрослых в возрасте от 18 до 55 лет предполагают, что она может быть многообещающей вакциной-кандидатом против COVID-19 [2,5]. В соответствии с нашей стратегией оценки нескольких вакцин-кандидатов на базе РНК и принятым на основе данных решением продвинуть кандидата с наилучшим профилем безопасности и иммуногенности, мы сравнили клинические данные, полученные после вакцинации BNT162b1 [2,5] с закодированным связыванием рецептор-связывающего домена (receptor-binding domain-RBD), с данными, полученными после вакцинации BNT162b2 с закодированным полноразмерным спайк-белком. Представленная здесь информация послужила основанием для нашего решения продвинуть BNT162b2 в дозе 30 мкг до фазы 2-3 международного испытания для оценки ее безопасности и эффективности у участников в возрасте от 18 до 85 лет.
Основным фактором, побудившим к этому решению, был более мягкий профиль системных реакций на BNT162b2, особенно у пожилых людей, в контексте аналогичных титров антител, вырабатываемых после введениях двух вакцин-кандидатов. Кратковременное снижение количества лимфоцитов после вакцинации не имело сопутствующих клинических проявлений, наблюдалось во всех возрастных группах и, вероятно, отражает временное перераспределение лимфоцитов из кровотока в лимфоидные ткани в качестве функционального ответа на иммунную стимуляцию вакциной. Иммунный ответ и профиль токсичности при выбранном, относительно низком уровне дозы в 30 мкг показывают, что вакцина-кандидат BNT162b2 на базе РНК, модифицированный нуклеозидами (modRNA), имеет благоприятный баланс реактогенности и иммуногенности [17,18].
Состав липидных наночастиц, компонентов препарата или выбор последовательности вакцины РНК могут влиять на профиль побочных эффектов. Причина более низкой реактогенности BNT162b2 неясна, учитывая, что обе вакцины используют одну и ту же базу modRNA, процессы производства и очистки РНК и состав липидных наночастиц. Они различаются нуклеотидными последовательностями, кодирующими вакцинные антигены, и общим размером конструкций РНК, то есть количество молекул РНК в 30 мкг BNT162b1 в 5 раз больше, чем в 30 мкг BNT162b2. Сообщалось, что нуклеотидный состав РНК влияет на ее иммуностимулирующую активность и профиль реактогенности, и это возможное объяснение различий у вакцин-кандидатов [19].
Иммунные ответы, вызванные BNT162b1 и BNT162b2, были сходными. Иммуногенность двух вакцин-кандидатов снижалась с возрастом, вызывая более низкие общие гуморальные реакции у взрослых в возрасте от 65 до 85 лет, чем у лиц от 18 до 55 лет. Похожий эффект наблюдался и с другими вакцинами, вероятно, это связано со снижением иммунного ответа из-за старения [20, 21]. Тем не менее через 7 и 14 дней после введения второй дозы 50% и 90% нейтрализующих титров антител, которые были вызваны 30 мкг BNT162b2 у пожилых людей, превышали таковые в панели реконвалесцентной плазмы. Титры антител как у молодых, так и у пожилых людей показали явное преимущество второй дозы.
Этот пробный и промежуточный отчет имеет несколько ограничений. Во-первых, относительная важность гуморального и клеточного иммунитета для защиты от COVID-19 еще полностью не охарактеризована. Хотя сильные клеточно-опосредованные иммунные ответы (Th1-смещенные CD4 + и CD8 +), вызванные BNT162b1, наблюдались в немецком исследовании [2], клеточные иммунные ответы, вызванные BNT162b2, все еще изучаются.
Во-вторых, хотя реакции нейтрализации сыворотки весьма обнадеживают, в сравнении с реакциями, вызванными естественной инфекцией, степень защиты от COVID-19, обеспеченная этим или любым другим способом, неизвестна.
В-третьих, в фазе 1 этого испытания проверялось множество гипотез, и не было возможности проводить формальные статистические сравнения.
В-четвертых, панели реконвалесцентной плазмы человека, которые использовались разными разработчиками вакцин, не стандартизированы для лабораторий, и каждая представляет собой уникальное распределение характеристик донора и времени сбора. Следовательно, панель сыворотки, которую мы использовали, не обеспечивает хорошо контролируемого эталона для сравнения серологических ответов, вызванных этими двумя BNT162 вакцинами-кандидатами, с реакциями, вызванными другими вакцинами-кандидатами.
Наконец, участники этого раннего клинического испытания были здоровы, состав участников не отличался расовым и этническим разнообразием по сравнению с населением в целом.
Многие из упомянутых выше ограничений рассматриваются в международных фазах 2–3 данного исследования. В этой ключевой части исследования мы оцениваем безопасность и эффективность двух доз в 30 мкг BNT162b2 максимум для 44000 участников (случайным образом выбранных в соотношении 1:1 для введения вакцины или плацебо) из разных слоев общества, включая людей со стабильным течением хронических заболеваний, повышенным риском из-за профессиональных вредностей, а также людей определенной расы и этнического происхождения с повышенным риском тяжелого течения COVID-19 [22]. Мы проводим информационно-разъяснительную работу, чтобы набрать участников испытаний из разных слоев общества, и используем данные переписи населения США для определения места проведения испытаний в различных округах.
Примечания к рисункам
Рисунок 1. Отбор и рандомизация участников
54 участника, которые не были отнесены к опытной группе, были обследованы, но не прошли рандомизацию, поскольку набор в исследование был закрыт. Все участники получили 2 дозы вакцины (BNT162b1 или BNT162b2) или плацебо, за исключением участников, получившим одну дозу 100 мкг BNT162b1 или плацебо.
Прим. перев.: Соотносятся между собой вакцина-кандидат или плацебо, доза, количество введений между такими характеристиками как: пол, раса: европеоидная, негроидная и монголоидная (азиаты), а также отдельно испаноязычная этническая группа, возраст.
Панель A показывает местные реакции у участников в возрасте от 18 до 55 лет, а панель B — у участников в возрасте от 65 до 85 лет. Реакции в месте введения препарата (местные) регистрировались в электронных дневниках в течение 7 дней после каждой инъекции. Боль в месте инъекции классифицировалась как легкая (не мешает физической активности), умеренная (мешает физической активности), сильная (препятствует повседневной активности) или степень 4 (привела к обращению в отделение неотложной помощи или госпитализации). Покраснение и отек классифицировались как легкие (от 2,0 до 5,0 см в диаметре), средней степени (от > 5,0 до 10,0 см в диаметре), тяжелой степени ( > 10,0 см в диаметре) или степени 4 (некроз или эксфолиативный дерматит из-за покраснения и некроза из-за отека). 𝙸 столбцы представляют 95% доверительный интервал. Цифры над полосами 𝙸 показывают общий процент участников в каждой группе, которые сообщили об указанной местной реакции. Ни один участник, получивший какую-либо вакцину-кандидат, не сообщил о местной реакции 4 степени.
Панель A показывает системные реакции у участников от 18 до 55 лет, а панель B — у участников от 65 до 85 лет. Здесь приведены данные о лихорадке, ознобе и слабости (данные о головной боли, рвоте, диарее, мышечной боли и боли в суставах представлены на рис. S1). Данные о системных реакциях записывались в электронные дневники в течение 7 дней после каждой инъекции. Шкала степеней лихорадки указана в ключе.
Прим. перев.:
Легкая — 38,0-38,4 ° C
Средняя >38,4-38,9 ° C
Тяжелая >38,9-40,0 ° C
Озноб и слабость классифицировались как легкие (не мешают активности), средней степени (несколько мешают активности), тяжелые (мешают повседневной активности) или 4 степени (привели к обращению в отделение неотложной помощи или госпитализации). 𝙸 столбцы представляют 95% доверительный интервал. Цифры над полосами 𝙸 показывают общий процент участников в каждой группе, которые сообщили об указанном системном событии. Ни один из участников, получивших вакцину-кандидат, не сообщил о системном событии 4 степени или о повышении температуры выше 40,0 ° C.
Рисунок 4. Иммуногенность BNT162b1 и BNT162b2
Участники в группах из 15 человек получали инъекцию с указанными дозами одного из кандидатов вакцины BNT162 (12 участников) или плацебо (3 участника) в дни 1 и 21. Стрелки указывают дни вакцинации. Ответы у реципиентов плацебо в каждой из групп объединены. Образцы сыворотки крови были получены перед инъекцией в 1 день и на 21, 28 и 35 дни после первой дозы. Образцы крови, полученные на 28 и 35 день, представляют собой образцы крови, полученные через 7 и 14 дней после второй дозы соответственно. Образцы реконвалесцентной плазмы (HCS) при COVID-19 были получены от 38 доноров не менее чем через 14 дней после подтверждения диагноза методом ПЦР, и в то время, когда у доноров не было симптомов. На панели A показаны средние геометрические концентрации рекомбинантного S1-связывающего IgG (нижний предел количественного определения, 1,267; пунктирная линия), а на панели B — средние геометрические титры, нейтрализующие 50% SARS-CoV-2 (нижний предел количественного определения, 20; штриховая линия). В дни, когда вводили вакцину или плацебо, образцы брали перед инъекцией вакцины/плацебо. Каждая точка данных представляет собой образец сыворотки, а верхняя часть каждой вертикальной полосы представляет собой среднее геометрическое с 95% доверительным интервалом (полоса). Точки данных, связанные с плацебо, образцами HCS или дозой в 10 мкг вакцины, показаны кружками, точки для дозы в 20 мкг — квадратами, а точки для дозы в 30 мкг — треугольниками. Цифры над столбиками показывают среднюю геометрическую концентрацию или средний геометрический титр в группе. Все группы вакцины имели 12 достоверных результатов для образцов, которые можно было оценить в каждый момент времени, за исключением следующего: среди участников, получивших BNT162b2, 11 результатов на 28-й день у более молодых участников, получивших 30 мкг, 10 результатов на 35-й день у более молодых участников, которые получили 30 мкг, и 11 результатов на 35-й день у пожилых участников, получивших 10 мкг.
Литература
1) Johns Hopkins University Coronavirus Resource Center. COVID-19 dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University. 2020 coronavirus.jhu.edu
2) Sahin U, Muik A, Derhovanessian E, et al. COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T-cell responses. Nature 2020 September 30 (Epub ahead of print). doi.org
3) Pardi N, Tuyishime S, Muramatsu H, et al. Expression kinetics of nucleoside-modified mRNA delivered in lipid nanoparticles to mice by various routes. J Control Release 2015;217:345-351. doi.org
4) Karikó K, Muramatsu H, Welsh FA, et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 2008;16:1833-1840. doi.org
5) Mulligan MJ, Lyke KE, Kitchin N, et al. Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults. Nature 2020 August 12 (Epub ahead of print). doi.org
6) He Y, Zhou Y, Liu S, et al. Receptor-binding domain of SARS-CoV spike protein induces highly potent neutralizing antibodies: implication for developing subunit vaccine. Biochem Biophys Res Commun 2004;324:773-781. doi.org
7) Güthe S, Kapinos L, Möglich A, Meier S, Grzesiek S, Kiefhaber T. Very fast folding and association of a trimerization domain from bacteriophage T4 fibritin. J Mol Biol 2004;337:905-915. doi.org
8) Bachmann MF, Zinkernagel RM. Neutralizing antiviral B cell responses. Annu Rev Immunol 1997;15:235-270. doi.org
9) Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020;367:1260-1263. doi.org
10) Pallesen J, Wang N, Corbett KS, et al. Immunogenicity and structures of a rationally designed prefusion MERS-CoV spike antigen. Proc Natl Acad Sci U S A 2017;114(35):E7348-E7357. doi.org
11) Xie X, Muruato A, Lokugamage KG, et al. An infectious cDNA clone of SARS-CoV-2. Cell Host Microbe 2020;27(5):841-848.e3. doi.org
12) Muruato AE, Fontes-Garfias CR, Ren P, et al. A high-throughput neutralizing antibody assay for COVID-19 diagnosis and vaccine evaluation. Nat Commun 2020;11:4059-4059. doi.org
13) Foster GR, Masri SH, David R, et al. IFN-α subtypes differentially affect human T cell motility. J Immunol 2004;173:1663-1670. doi.org
14) Hopkins RJ, Daczkowski NF, Kaptur PE, et al. Randomized, double-blind, placebo-controlled, safety and immunogenicity study of 4 formulations of Anthrax Vaccine Adsorbed plus CPG 7909 (AV7909) in healthy adult volunteers. Vaccine 2013;31:3051-3058. doi.org
15) Regules JA, Beigel JH, Paolino KM, et al. A recombinant vesicular stomatitis virus Ebola vaccine. N Engl J Med 2017;376:330-341. doi.org
16) Lai L, Davey R, Beck A, et al. Emergency postexposure vaccination with vesicular stomatitis virus-vectored Ebola vaccine after needlestick. JAMA 2015;313:1249-1255. doi.org
17) Feldman RA, Fuhr R, Smolenov I, et al. mRNA vaccines against H10N8 and H7N9 influenza viruses of pandemic potential are immunogenic and well tolerated in healthy adults in phase 1 randomized clinical trials. Vaccine 2019;37:3326-3334. doi.org
18) Jackson LA, Anderson EJ, Rouphael NG, et al. An mRNA vaccine against SARS-CoV-2 — preliminary report. N Engl J Med. doi.org
19) Kondili M, Roux M, Vabret N, Bailly-Bechet M. Innate immune system activation by viral RNA: how to predict it? Virology 2016;488:169-178. doi.org
20) Muñoz N, Manalastas R Jr, Pitisuttithum P, et al. Safety, immunogenicity, and efficacy of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged 24-45 years: a randomised, double-blind trial. Lancet 2009;373:1949-1957. doi.org
21) Boraschi D, Del Giudice G, Dutel C, Ivanoff B, Rappuoli R, Grubeck-Loebenstein B. Ageing and immunity: addressing immune senescence to ensure healthy ageing. Vaccine 2010;28:3627-3631. doi.org
22) Stokes EK, Zambrano LD, Anderson KN, et al. Coronavirus disease 2019 case surveillance — United States, January 22–May 30, 2020. MMWR Morb Mortal Wkly Rep 2020;69:759-765. doi.org