Реконвалесцентная плазма в лечении коронавирусной болезни 2019 (COVID-19): рекомендации по проведению клинических исследований

Оригинал: Transfusion
Автор: Paul Barone, Robert A. DeSimone, Department of Pathology and Laboratory Medicine, Weill Cornell Medicine, New York, NY
Опубликовано: 06 мая 2020, transfusion.org
Перевод: Наталья Карпова, Фонд профилактики рака
Использование реконвалесцентной плазмы при COVID-19
Недавно в Китае были составлены две серии случаев, изучающих терапевтическое применение РП (реконвалесцентной плазмы) у пациентов с COVID-19 [13, 14]. Во время этих двух исследований лечили в общей сложности 15 пациентов; все они были тяжело больны до переливания крови и у них был положительный ПЦР-тест на SARS-CoV-2. Донорскую плазму протестировали на титр нейтрализующих антител (≥ 1:40 у 5 исследуемых пациентов; ≥ 1:640 у 10 исследуемых пациентов). Вся плазма была обработана фотохимией метиленовым синим и хранилась при температуре 4 °C (никогда не замораживалась). В обоих исследованиях состояние пациентов улучшилось, включая клиренс вируса, снижение потребности в дополнительном кислороде и искусственной вентиляции легких, нормализацию лабораторных показателей и улучшение результатов рентгенологического исследования легких. Следует отметить, что в исследовании с участием 10 пациентов выздоровление было более быстрым у пациентов, получавших РП до 14 дней после начала болезни (ДПНБ), чем у тех, кто получил ее позже [14]. Ни одно исследование не имело контрольной группы.
Эти данные обнадеживают, однако они имеют существенные ограничения и должны сопровождаться дополнительными исследованиями. Оба исследования были направлены на тяжелобольных пациентов, у которых также были положительные титры нейтрализующих антител до получения РП, причем некоторые пациенты в исследовании Дуана и коллег [14] имели предтрансфузионные титры ≥1:640 [14]. Авторы не указывали уровень титров выше этого даже для посттрансфузионного титра нейтрализующих антител, поэтому неясно, увеличивался ли у этих пациентов титр нейтрализующих антител в связи с трансфузией [14]. Из-за этого трудно объяснить, каким образом РП могла принести пользу пациентам.
В исследовании Shen и его коллег [13] с меньшим числом пациентов (n=5) авторы представили титр нейтрализующих антител каждого пациента до и после переливания, а также изменение клинических параметров для каждого отдельного пациента в течение нескольких дней после переливания. Некоторые параметры свидетельствуют о том, что пациенты с более высоким титром нейтрализующих антител перед трансфузией имели худшее клиническое течение после трансфузии, чем пациенты с более низкими титрами. Например, у пациента с самым высоким титром нейтрализующих антител перед трансфузией (≥ 1:160) наблюдалось наименьшее улучшение PaO2/FiO2 (от 276 до 284 мм рт.ст. в течение 12 дней) по сравнению со средним улучшением от 193 до 336 мм рт.ст. у остальных четырех пациентов. Этому пациенту также потребовалось больше всего дней (7), чтобы стать афебрильным после переливания крови, по сравнению с 1-3 днями у 3 других пациентов (последний пациент не был фебрильным до получения РП). Наконец, пациент с предтрансфузионным титром нейтрализующих антител ≥ 1:160 был одним из двух пациентов, которые оставались интубированными в конце исследования. Другой интубированный пациент имел один из самых низких уровней титра нейтрализующих антител перед трансфузией (≥ 1:40); однако это был также единственный пациент, которому требовалась экстракорпоральная мембранная оксигенация (ЭКМО) перед трансфузией. Изменения других параметров, таких как уровень С-реактивного белка (СРБ) и оценка последовательной органной недостаточности, менее убедительны. Тем не менее, эти результаты согласуются с концепцией о том, что пациенты на ранних стадиях клинического течения, когда уровень титра нейтрализующих антител все еще низок или не обнаруживается, могут лучше реагировать на РП, чем пациенты, которые находятся на более поздних стадиях заболевания. Было бы полезно дополнительное изучение РП на ранних стадиях заболевания или даже в качестве профилактики у пациентов, подвергшихся воздействию вируса.
С 11 апреля 2020 года Управление по контролю качества пищевых продуктов и лекарственных средств СШАустановило особые требования к донорству РП. Они подробно описаны в Таблице 1 [15]. Хотя тестирование титра нейтрализующих антител рекомендуется проводить с значением отсечки ≥1:160, оно не обязательно, и некоторые поставщики крови США не выполняют тест на титры нейтрализующих антител до предоставления РП в службы переливания крови. Исследования еще не установили, какой минимальный титр нейтрализующих антител необходим для терапевтической пользы РП, но приведенная выше серия случаев продемонстрировала, что некоторый уровень нейтрализующих антител присутствовал в донорской плазме до переливания. Ключевой вопрос, который следует рассмотреть — какой процент пациентов с COVID-19 вырабатывает нейтрализующие антитела и в течение какого времени. Согласно одному исследованию, в котором измерили нейтрализующие антитела у 175 пациентов, инфицированных вирусом, все пациенты имели низкие титры нейтрализующих антител, определенные как < 1:500, на 10-й ДПНБ. Титры нейтрализующих антител у них увеличивались с 10-15-го дня и после этого были практически стабильны [16]. Только у 10 из 175 пациентов никогда не развивались обнаруживаемые титры нейтрализующих антител (< 1:40), а 70 % в конечном итоге генерировали титры нейтрализующих антител > 1:500. Пациенты с низкими титрами были, как правило, моложе и чаще женского пола. Титр нейтрализующих антител положительно коррелировал с уровнем СРБ, но отрицательно — с количеством лимфоцитов. Другое исследование показало, что обнаруживаемые анти-SARS-CoV-2 IgG антитела появляются между 6-10 днями после заражения. Интересно, что IgG появляется примерно в то же время, что и IgM [17]. Эти антитела были обнаружены методом иммуноферментного анализа и поэтому не обязательно являются нейтрализующими антителами. Однако уровень IgG в этом исследовании сильно коррелировал с титрами нейтрализующих антител.
Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) предоставило три возможности для введения РП пациентам с COVID-19 [15]. Первая — согласно «Протоколу расширенного доступа к реконвалесцентной плазме для лечения пациентов с COVID-19», спонсируемая клиникой Майо (Mayo Clinic). Пациенты, удовлетворяющие определенным критериям (> 18 лет, с лабораторно подтвержденным диагнозом, требующим госпитализации в отделение неотложной помощи с высоким риском прогрессирования тяжелого или угрожающего жизни заболевания), могут зарегистрироваться для получения трансфузии в участвующем центре. Вторая возможность — это применение для каждого отдельного пациента Экстренного исследования нового препарата (EIND), которое утверждает лицензированный врач и FDA и не требует обращения в специальный центр; однако критерии приемлемости такого применения аналогичны критериям для Протокола расширенного доступа [15]. Третья возможность — это клинические испытания.
Клинические испытания
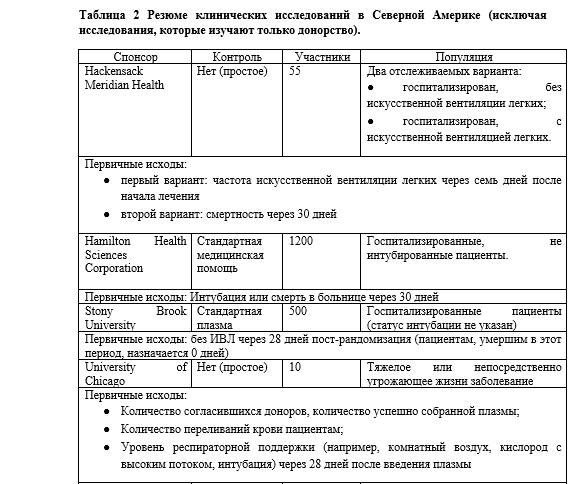
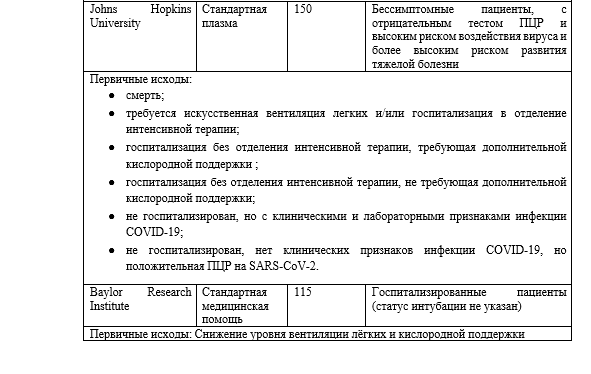
По всему миру начали большое число клинических испытаний, многие из которых проходят в США и Канаде. Подробная информация о некоторых североамериканских исследованиях приведена в Таблице 2; многие другие испытания проводятся на международном уровне. Все эти исследования будут изучать использование РП у различных групп пациентов; некоторые из них будут сосредоточены на тяжелобольных пациентах, на ту же группу нацелена программа «Расширенного доступа». Другие будут нацелены на госпитализированных, но не интубированных пациентов. Некоторые исследования явно не направлены ни на то, ни на другое; будут ли они в конечном итоге объединять тяжелобольных и умеренно больных пациентов вместе или анализировать их отдельно, пока неясно. По крайней мере одно исследование будет нацелено на людей с высоким риском, которые подверглись воздействию вируса, но еще не получили положительного результата теста и не проявили никаких симптомов. Как было показано выше в работе с SARS и в более крупных сериях случаев COVID-19, РП может быть более эффективна на ранних стадиях заболевания. Исследования RSV (респираторно-синцитиального вируса), HIVIG (анти-ВИЧ иммуноглобулин), между тем, показали только пользу при профилактическом применении. Эти испытания помогут установить, каковы оптимальные сроки введения препарата.
Не все клинические испытания имеют контрольную группу, и те, которые ее имеют, различаются по типу контроля. Некоторые будут использовать стандартную плазму в качестве контроля, в то время как другие будут просто использовать стандартную медицинскую помощь. Стандартная плазма имеет преимущество — позволяет проводить слепое исследование. Однако она также несет в себе недостатки: такое исследование будет потреблять ценный продукт крови без ожидаемой клинической пользы, оно будет подвергать пациентов воздействию потенциально иммуногенных антигенов, которые осложнят будущие переливания, что подвергнет пациентов риску развития реакций на переливание. Кроме того, использование стандартной плазмы, которая несет в себе многие из тех же рисков РП, но не имеет никаких преимуществ, может маскировать некоторые риски использования РП, которые было бы легче обнаружить, если бы в качестве контроля использовалась стандартная медицинская помощь.
Показатели исходов различных испытаний варьируются в зависимости от конкретных целей индивидуальных испытаний. Некоторые исследования особенно нацелены на возможность идентификации доноров и сбора плазмы крови. Таким образом, переменная интереса — это успешно отобранные доноры, подписанные согласия и собранные единицы плазмы. Результаты исследований по профилактическому применению РП включают частоту ПЦР-обнаружения вируса, частоту появления симптомов, госпитализацию сиспользованием кислорода и без него, интубацию и смерть после воздействия. Исследования, сфокусированные на неинтубированных, госпитализированных пациентах, устанавливали в качестве переменных интереса оценку как улучшения (снижение потребности в кислороде), так и ухудшения (интубация и смерть). Исследования, ориентированные на тяжелобольных пациентов, обычно включают смерть в качестве переменной интереса, а также снижение поддержки ИВЛ.
Первичные переменные интереса редко отклоняются от этих вариантов, но вторичные переменные интереса гораздо более вариабельны, включая продолжительность госпитализации (иногда с указанием продолжительности пребывания в отделении интенсивной терапии (ОИТ) или не ОИТ), титры антител в установленные дни после переливания, скорость клиренса вируса, влияние уровня титра донора на эффективность, необходимость ЭКМО или заместительной почечной терапии и даже начало миокардита. Высокая степень совпадения первичных переменных интереса облегчит сравнение и мета-анализ исследований, в то время как вариабельность вторичных переменных интереса позволит отдельным исследованиям ответить на более конкретные вопросы об использовании РП в лечении COVID-19.
Выводы
РП находится в стадии активного исследования в качестве прямого лечения при COVID-19, а также профилактики. Использование РП при COVID-19 и других вирусах показало себя многообещающим. Критические факторы, которые необходимо учитывать при разработке протоколов лечения, включают время введения препарата относительно начала заболевания, время донорства относительно разрешения симптомов, тяжесть заболевания донора, предтрансфузионную серологию реципиента и титры антител донора. Итоговые показатели должны быть адаптированы к изучаемому населению.
Ссылки
[13] Shen C, Wang Z, Zhao F, et al. Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma. JAMA 2020. [Epub ahead of print]
[14] Duan K, Liu B, Li C, Zhang H, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci USA 2020. [Epub ahead of print]
[15] United States Food and Drug Administration. Recommendations for investigational COVID-19 convalescent plasma. 2020 April 13. Available from: https://www.fda.gov/vaccines-blood-biologics/investigational-new-drug-ind-or-device-exemption-ide-process-cber/recommendations-investigational-covid-19-convalescent-plasma. Accessed April 13, 2020.
[16] Wu F, Wang A, Liu M, et al. Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. medRxiv 2020. [Pre-print, not peer-reviewed]
[17] To KK, Tsang OT, Leung WS, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis 2020. [Epub ahead of print]