Коронавирусное заболевание 2019 (COVID-19): особенности ведения пациентов с признаками гиперкоагуляции

Оригинал: Coronavirus disease 2019 (COVID-19): Hypercoagulability
Автор: Adam Cuker, MD, MS et al.
Опубликовано: 28 мая 2020, последнее обновление 12 октября 2020, UpToDate
Перевод: Наталия Шахгильдян, Полина Дроздова, Фонд профилактики рака
Редакция: Елена Попова, Фонд профилактики рака
Введение
Новый коронавирус был впервые выявлен в конце 2019 года, и масштаб его распространения быстро достиг уровня пандемии. Всемирная организация здравоохранения (ВОЗ) назвала заболевание, вызываемое данным вирусом (SARS-CoV-2), коронавирусным заболеванием 2019 года (COVID-19).
У пациентов с COVID-19 может наблюдаться ряд сложных и разнообразных нарушений коагуляции (в связи с исходным состоянием гиперкоагуляции), поэтому возникает вопрос о соответствующих мерах диагностики и вмешательства для предотвращения и лечения тромбозов.
В данном разделе рассматривается диагностика и ведение нарушений свертываемости крови у пациентов с COVID-19.
Другие темы, связанные с COVID-19, рассматриваются в следующих разделах:
- Коронавирусное заболевание 2019 (COVID-19): тактика ведения у взрослых пациентов (Coronavirus disease 2019 (COVID-19): Management in hospitalized adults).
- Коронавирусное заболевание 2019 (COVID-19): вопросы интенсивной терапии и обеспечения проходимости дыхательных путей (Coronavirus disease 2019 (COVID-19): Critical care and airway management issues).
- Экстракорпоральная мембранная оксигенация (ЭКМО) (Extracorporeal membrane oxygenation (ECMO) in adults).
- Коронавирусное заболевание 2019 (COVID-19): особенности ведения у беременных(Coronavirus disease 2019 (COVID-19): Pregnancy issues).
- Коронавирусное заболевание 2019 (COVID-19): Особенности анестезии, в том числе обеспечение проходимости дыхательных путей и контроль инфекции (Coronavirus disease 2019 (COVID-19): Anesthetic concerns, including airway management and infection control).
Патогенез
Механизм развития гиперкоагуляции при COVID-19 на данный момент не изучен полностью.
Триада Вирхова. Гиперкоагуляция может быть рассмотрена с точки зрения триады Вирхова ("Overview of the causes of venous thrombosis", раздел "Virchow's triad"). Все три фактора, способствующие развитию тромбоза, встречаются и у пациентов с тяжелым течением COVID-19:
- Повреждение клеток эндотелия. Есть данные о прямом внедрении вируса SARS-CoV-2 в эндотелиальные клетки, что потенциально может вести к их повреждению. Были выдвинуты предположения о том, что повреждение эндотелия, микроваскулярное воспаление, эндотелиальный экзоцитоз и/или эндотелиит играют главную роль в патогенезе острого респираторного дистресс-синдрома и органной недостаточности у пациентов с тяжелым течением COVID-19 [1,2,3]. (См. разделы "ВТЭ" и «Микроваскулярный тромбоз» далее, а также рекомендации "Коронавирусное заболевание 2019 (COVID-19): вопросы интенсивной терапии и обеспечения проходимости дыхательных путей, раздел "Клиническая картина у пациентов в критическом состоянии").
Другие наблюдения позволили предположить участие в протромботическом состоянии при COVID-19 нейтрофильных внеклеточных ловушек (neutrophil extracellular traps, NETs) — формы деконденсированного хроматина из погибших или погибающих нейтрофилов [4,5]. (См. также: "Disseminated intravascular coagulation (DIC) in adults: Evaluation and management", раздел "Role of extracellular cell-free DNA and DNA-binding proteins").
Другие источники повреждений эндотелия включают внутрисосудистые катетеры и медиаторы острых воспалительных реакций — цитокины (например, IL-6) и другие факторы острой фазы воспаления [6]. Также определенный вклад вносит комплемент-зависимое повреждение эндотелия [7]. (См. также: "The endothelium: A primer, Complications of central venous catheters and their prevention", "Acute phase reactants").
Нарушение кровотока. Длительная неподвижность может привести к гемостазу у любых пациентов, независимо от того, болеют ли они COVID-19.
Гиперкоагуляция. Известно об изменениях нескольких циркулирующих протромботических факторов у тяжелых пациентов с COVID-19 [8,9,10]:
— повышенный уровень фактора VIII;
— повышенный уровень фибриногена;
— циркулирующие протромботические микрочастицы;
— нейтрофильные внеклеточные ловушки (NETs);
— повышенная вязкость крови.
Повышение вязкости крови было продемонстрировано в исследовании серии случаев у 15 пациентов в крайне тяжелом состоянии, находящихся на лечении в ОРИТ [11]. У всех 15 пациентов при помощи метода капиллярной вискозиметрии было установлено повышение вязкости крови (1,9–4,2 сентипауз [сП], N = 1,4–1,8 сП). Принято считать, что повышенная вязкость увеличивает вероятность развития гиперкоагуляционного состояния. Повышенная вязкость часто наблюдается при моноклональных гаммапатиях, особенно при макроглобулинемии Вальденстрёма, но также может быть вызвана поликлональной гипергаммаглобулинемией и/или увеличением других белковых фракций (например, фибриногена). (См. также: "Laboratory test reference ranges in adults", раздел "Viscosity, serum").
Также наблюдался значительно повышенный уровень D-димера, коррелирующий с тяжестью заболевания. D-димер — продукт распада фибрина, индикатор усиленного образования тромбина и распада фибрина под действием плазмина [12]. Тем не менее, высокий уровень D-димера часто встречается у любых тяжело больных пациентов с некоторыми инфекционными и воспалительными заболеваниями. Для вирусных инфекций также характерно образование антифосфолипидных антител, под действием которых может происходить удлинение активированного частичного тромбопластинового времени (АЧТВ). Однако их появление не всегда указывает на повышенный риск тромбозов (см. далее "Нарушение свертываемости» и «Клинические признаки").
Также обсуждается потенциальная роль активации тромбоцитов в развитии тромбоза, однако данных пока немного [13,14].
Нарушения свертываемости. Преобладающие варианты нарушения свертываемости у пациентов с COVID-19 предполагают развитие гиперкоагуляции, что согласуется с данными неконтролируемых клинических исследований, свидетельствующих о повышенном риске венозной тромбоэмболии (см. "ВТЭ" далее).
Некоторые эксперты называют повышенный риск венозной тромбоэмболии при COVID-19 «тромботическим воспалением» или COVID-19-ассоциированной коагулопатией (COVID-19-associated coagulopathy, CAC) [15,16]. Это состояние значительно отличается от синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома), хотя известны случаи развития ДВС-синдрома у некоторых пациентов с тяжелым течением COVID-19.
В исследовании 24 пациентов на ИВЛ с пневмонией тяжелого течения, вызванной COVID-19, были описаны характерные результаты лабораторных исследований, которые включали коагулограмму, исследование фактора Виллебранда (VWF) и тромбоэластографию (ТЭГ) [8]:
- Протромбиновое время (ПТВ) и активированное частичное тромбопластиновое время (АЧТВ) в норме или немного удлинены.
- Содержание тромбоцитов в норме или немного повышено (в среднем 348 тыс. ед/мкл).
- Содержание фибриногена увеличено: в среднем 680 мг/дл (интервал 234–1344 мг/дл).
- Содержание D-димера повышено:в среднем 4487 нг/мл (интервал 1197–16954 нг/мл).
Другие исследования
- Активность фактора VIII повышена (в среднем 297 ед/дл).
- Содержание антигена фактора Виллебранда значительно повышено (среднее 529, интервал 210–863), что соответствует повреждению эндотелия.
- Естественные антикоагулянты: небольшое снижение содержания антитромбина и свободного протеина S, небольшое повышение содержания протеина С.
Результаты тромбоэластографии
- Время реакции (R) укорочено из-за раннего образования значительного количества тромбина — «тромбиновый взрыв», что наблюдается у 50 % пациентов.
- Время формирования сгустка (К) укорочено у 83 % пациентов (увеличение образования фибрина).
- Максимальная амплитуда (МА) увеличена у 83 % пациентов (повышенная прочность сгустков).
- Индекс лизиса тромба через 30 минут (LY30) снижен у 100 % (снижение активности фибринолиза).
Исследования проводились на артериальной крови, так как у пациентов были установлены артериальные катетеры, однако допустимо использование и венозной крови. Так как большинство пациентов получали низкомолекулярный гепарин (НМГ), необходимо было использовать гепариназу.
Другие исследования описывают похожие наблюдения, в том числе значительное повышение уровня D-димера, активности фактора Виллебранда и содержания его антигена и увеличение активности фактора VIII [9,17]. В одном исследовании, в котором проводили ТЭГ для 44 пациентов в ОРИТ, обнаружили полное отсутствие лизиса сгустка (LY30 равное 0 %) в 57 % случаев, что называют «отключением фибринолиза» (fibrinolysis shutdown) и ассоциируют с высокой частотой отказа почек и тромбоэмболических событий [18]. Авторы другого исследования предположили, что у пациентов с COVID-19 содержание тромбоцитов выше, чем у пациентов с другими коронавирусными заболеваниями [19]. В исследовании, проведенном в Ирландии, лабораторные показатели 50 пациентов терапевтических отделений, такие как высокий D-димер и фибриноген и нормальный уровень тромбоцитов и показатели времени свертывания, были сходными и у пациентов ОРИТ [20].
Авторы ранних исследований, включавших в том числе исследование с 183 пациентами из г. Ухань (Китай), предполагали, что для пациентов с COVID-19 характерны выраженная тромбоцитопения и удлинение ПТВ и АЧТВ [21,22,23,24]. Неясно, почему результаты более поздних исследований отличаются незначительным удлинением ПТВ и АЧТВ. Возможно, в ранний период пандемии пациенты находились в более тяжелом состоянии: диагностика занимала больше времени. Из-за этого госпитализация и лечение происходили с задержками. Были сообщения о случаях иммунной тромбоцитопении (ИТП), ассоциированной с COVID-19 [25,26,27,28].
Изолированное удлинение АЧТВ может быть также объяснено присутствием волчаночного антикоагулянта (ВА) ("Clinical use of coagulation tests", раздел "Causes of prolonged aPTT"). В двух исследованиях было показано высокое содержание ВА в крови у пациентов с удлиненным АЧТВ (у 50 из 57 пациентов [88 %] и у 31 из 34 пациентов [91 %]) [17,29]. В другом исследовании, в рамках которого проводили повторное тестирование 10 пациентов с наличием ВА и COVID-19 через несколько недель, выяснили, что у девяти из 10 пациентов ВА не был обнаружен [30]. Явление временного наличия антифосфолипидных антител (АФА) часто встречается у пациентов с острой вирусной инфекцией и не означает антифосфолипидный синдром (см. "Diagnosis of antiphospholipid syndrome", раздел "Antiphospholipid antibody testing"). Тем не менее, наличие ВА может коррелировать с тромбозом у пациентов COVID-19 [31]. Наличие ВА может привести к удлинению АЧТВ, однако это не отражает истинное увеличение риска кровотечений. При наличии показаний пациентам с положительным результатом анализа на ВА необходима антикоагулянтная терапия (См. далее "Ведение заболевания").
Некоторые маркеры изменения процесса коагуляции, например, D-димер, коррелируют с тяжестью заболевания. D-димер часто повышен, иногда до очень высоких показателей, у пациентов с ДВС и у тех, кто находится на лечении в ОРИТ.
Принципы тромбоэластографии более подробно обсуждаются в других источниках ("Platelet function testing, раздел Thromboelastography (TEG) and ROTEM" и "Coagulopathy in trauma patients, раздел Thromboelastography").
Отличия от ДВС. Некоторые источники упоминают гиперкоагуляцию при COVID-19 как состояние, сходное с ДВС, так как у многих пациентов достаточно критериев для предполагаемого ДВС по шкале ISTH (International Society on Thrombosis and Haemostasis — Международное сообщество тромбоза и гемостаза) 2009 г. [32]. Важно отметить, что для COVID-19 характерны тромбозы, а основной признак острого декомпенсированного ДВС-синдрома — кровотечение (см. далее "Клинические признаки"). Результаты некоторых лабораторных исследований также сходны при COVID-19 и ДВС-синдроме, например, в обоих случаях повышается уровень D-димера и наблюдается незначительная тромбоцитопения. Однако другие лабораторные показатели у пациентов с COVID-19 и ДВС-синдромом отличаются. При COVID-19 повышается уровень фибриногена и фактора VIII, значит, можно предположить, что перепотребления факторов свертывания не происходит [8] (см. выше "Нарушение свертываемости").
При остром декомпенсированном ДВС-синдроме фибриноген, наоборот, снижается. В одном из крупнейших исследований, описывающем тромбоэмболические осложнения, ни у одного пациента не было зарегистрировано ДВС [33].
Для острого декомпенсированного ДВС-синдрома характерны кровотечения, в то время как при хроническом компенсированном ДВС-синдроме распространены тромбозы, однако эти состояния значительно перекрываются. Так, состояние гиперкоагуляции при COVID-19 больше всего похоже на компенсированный ДВС, но при COVID-19 значения тромбоцитов и АЧТВ остаются в норме ("Disseminated intravascular coagulation (DIC) in adults: Evaluation and management, раздел "Pathogenesis").
Шкала ISTH основана на лабораторных показателях и разработана для применения только у пациентов с состояниями, ассоциированными с развитием ДВС [32]. COVID-19 может подходить под одно из таких состояний, так как является тяжелой инфекцией. Баллы начисляются за тромбоцитопению (1 балл за уровень тромбоцитов от 50–100 тыс. ед/мкл; 2 балла за < 50 тыс. ед/мкл), удлинение ПТВ (1 балл за удлинение на 3–6 сек.; 2 балла за удлинение более чем на 6 сек.), снижение уровня фибриногена (1 балл за < 100 мг/дл), повышение D-димера (2 балла за умеренное повышение, 3 балла за значительное повышение). Если сумма равна 5 или более баллов, то ДВС-синдром вероятен. Несмотря на это, диагноз «ДВС-синдром» ставится по клиническим данным: сейчас нет ни одного теста, который был бы «золотым стандартом» диагностики. Чувствительность шкалы ISTH составляет 91 %, специфичность — 97 % в сравнении с мнением экспертов [32] (см. ранее "Нарушение свертываемости").
Независимо от того, считаем ли мы более важным сходство или различие ДВС-синдрома и гиперкоагуляции при COVID-19, многие базовые принципы ведения ДВС-синдрома применяются у пациентов с коронавирусной инфекцией. Среди них — лечение самой инфекции, внимание к клиническому состоянию пациента, а не только к его лабораторным показателей, обеспечение антикоагуляции при тромбозе и соответствующие меры гемостаза при кровотечении ("Disseminated intravascular coagulation (DIC) in adults: Evaluation and management", раздел "Treatment").
Клинические признаки
Одной из наиболее важных особенностей COVID-19 является широкий спектр клинических проявлений и последствий, от бессимптомного течения до нарушения функционирования многих органов и смерти (см. "Coronavirus disease 2019 (COVID-19): Clinical features"). Сходным образом, спектр тромбоэмболических проявлений широк и, согласно имеющимся данным, варьирует между пациентами и клиническими исследованиями.
Венозная тромбоэмболия. ВТЭ, в том числе обширный тромбоз глубоких вен и тромбоэмболия легочной артерии (ТЭЛА), очень часто встречается у пациентов с острым COVID-19 и наблюдается у одной трети всех пациентов, находящихся на лечении в ОРИТ, несмотря на профилактическую антикоагуляцию.
В большом исследовании, в которое были включены более 3000 госпитализированных пациентов, большинство из которых получали антикоагулянты в профилактических дозах, факторами риска ВТЭ в многофакторном анализе оказались пожилой возраст, мужской пол, латиноамериканское происхождение и высокий уровень D-димера (> 500 нг/мл) при поступлении в стационар [34]. ВТЭ была ассоциирована с повышенным уровнем смертности (отношение рисков [ОР] 1,37; 95 % доверительный интервал [ДИ] 1,02–1,86).
В нескольких исследованиях, в которых изучались результаты аутопсий пациентов с COVID-19, подчеркивалось, что гиперкоагуляция и воспалительные процессы в легких играют большую роль в развитии летальных исходов у пациентов:
- Посмертные исследования 21 пациента с COVID-19 выявили наличие ТЭЛА у 4 пациентов, при этом у пяти из 11 пациентов, у которых были доступны гистологические препараты, были обнаружены микротромбы в альвеолярных капиллярах [35]. У трех пациентов были выявлены признаки тромботической микроангиопатии с образованием фибриновых тромбов в гломерулярных капиллярах. Средний возраст пациентов составлял 76 лет, у большинства также были высокие показатели индекса массы тела (средний ИМТ 31 кг/м2, в норме 18,5–25,0). Только у 11 пациентов имелись данные о приеме антикоагулянтов, и все 11 пациентов получали антикоагулянтную терапию в том или ином виде. Большинство имели сопутствующие заболевания, такие как заболевания сердечно-сосудистой системы, включая гипертоническую болезнь, а также сахарный диабет.
- Посмертное исследование 12 пациентов с COVID-19 (8 мужчин, 10 госпитализированы) показало наличие тромбоза глубоких вен у семи из 12 пациентов (58 %) [36]. Во всех случаях были вовлечены обе нижние конечности. Ни один случай не был заподозрен до смерти пациента. Из 12 пациентов у пяти (42 %) при гистологическом исследовании ткани легких были обнаружены признаки тромбоза. ТЭЛА стала причиной смерти четырех пациентов. У некоторых пациентов были определены крайне высокие показатели D-димера (у двоих более 20 тыс. нг/мл и у одного > 100 тыс. нг/мл; нормальное значение менее 500 нг/мл). Антикоагулянтная терапия проводилась только у четырех из 12 пациентов. Средний ИМТ составил 28,7 кг/м2. Только у троих пациентов ИМТ был в пределах нормы, однако у них имелись онкологические заболевания, язвенный колит и/или хроническая болезнь почек.
- В другом исследовании сравнивались повреждения легких, выявленные при аутопсии у семи пациентов, умерших от COVID-19. Было обнаружено тяжелое повреждение эндотелия (эндотелиалит), распространенные тромбозы с микроангиопатиями и микротромбы в альвеолярных капиллярах, а также повышенный ангиогенез. Эти поражения были значительно более сильно выражены у пациентов, умерших от COVID-19 по сравнению с пациентами в контрольной группе, умершими от гриппа или других причин [37].
Авторы данных исследований отмечают превалирование среди пациентов мужчин с высокой распространенностью ожирения и других сопутствующих хронических состояний, особенно сердечно-сосудистых заболеваний, включая гипертоническую болезнь, и сахарный диабет. Результаты более поздних исследований также согласуются с этими выводами [38].
ОРИТ. В исследовании пациентов ОРИТ зафиксирован достаточно высокий уровень ВТЭ (20–43 %), несмотря на профилактические дозы антикоагулянтов. Чаще всего происходила тромбоэмболия легочной артерии (ТЭЛА).
- При исследовании 829 тяжелых пациентов с COVID-19, находившихся на лечении в ОРИТ, ВТЭ была зарегистрирована в 13,6 % случаев (ТЭЛА в 6,2 % и ДВС в 9,4 %); эти значения ниже, чем опубликованные в предыдущих работах [34]. Причины снижения встречаемости ВТЭ неочевидны; они могут включать повышение эффективности медицинской помощи с учетом новых данных, увеличение использования антикоагулянтов или снижение объема диагностики в связи с большим количество пациентов в ОРИТ.
- При исследовании 184 тяжелых пациентов с COVID-19, находившихся на лечении в ОРИТ, ТЭЛА была зарегистрирована у 25 пациентов (14 %); тромбоз глубоких вен — у одного; катетер-ассоциированный тромбоз — у двоих [33]. Кумулятивная заболеваемость ВТЭ, основанная на различных периодах наблюдения, — 27 %. Все пациенты получали как минимум одну стандартную дозу препаратов для профилактики тромбозов.
- При исследовании 150 пациентов, проходивших лечение в ОРИТ, ВТЭ была зарегистрирована у 64 пациентов (43 %, в основном ТЭЛА). Тромбоз экстракорпорального контура был зарегистрирован у 28 из 29 пациентов, получающих постоянную заместительную почечную терапию, а также у двух из 12 пациентов, находящихся на экстракорпоральной мембранной оксигенации (ЭКМО) [17]. У всех пациентов проводилась тромбопрофилактика (преимущественно НМГ): 70 % пациентов получали профилактические дозы, 30 % — терапевтические.
- В более ранних исследованиях пациентов, находившихся на лечении в ОРИТ, ВТЭ была зарегистрирована у 22–39 % пациентов, во многих случаях несмотря на профилактический прием антикоагулянтов [39,40,41]. Эти значения выше, чем для сравнимых когорт (пациенты, находившиеся на лечении в ОРИТ в такой же временной интервал предыдущего года, пациенты с гриппом, находившиеся на лечении в тот же период, и пациенты с острым респираторным дистресс-синдромом, не связанным с COVID-19); во всех этих группах частота ВТЭ составляла не более 8 % [17,39]. У некоторых из этих пациентов также были коморбидные патологии, в том числе онкологические заболевания и почечная недостаточность [33].
Частота ТГВ была выше в исследованиях, в которых проводили скрининговое УЗИ нижних конечностей. В двух небольших исследованиях, в которых проводились скрининговое УЗИ нижних конечностей пациентов с COVID-19 (34 и 26 пациента соответственно), ТГВ наблюдали в 65–69 % случаев; в одном из исследований наблюдали образование двусторонних тромбов в 38 % случаев [42,43]. Некоторые случа ТГВ происходили на фоне приема антикоагулянтов до госпитализации или профилактического назначения антикоагулянтов при госпитализации.
В целом риск ВТЭ достаточно высок, чтобы некоторые эксперты рекомендовали выбор более высоких профилактических доз или даже назначение эмпирических терапевтических доз антикоагулянтов. Авторы некоторых исследований отмечали, что у пациентов с ВТЭ ИМТ превышал средние значения. Соответственно, выбор интенсивности антикоагулянтной терапии должен учитывать ожирение наряду с другими факторами риска (см. далее "Возможная роль полных доз антикоагулянтов у пациентов в крайне тяжелом состоянии").
Терапевтические пациенты (не находящиеся в ОРИТ). О распространенности ВТЭ у стационарных пациентов, которые проходят лечение не в ОРИТ, доступно меньше данных.
- В ретроспективном исследовании, в которое были включены 1240 пациентов стационара, с помощью КТ-ангиопульмонографии обнаружили ТЭЛА у 103 пациентов (8,3 %) [44]. Согласно результатам многофакторного анализа, факторами риска ТЭЛА являются мужской пол, высокий уровень C-реактивного белка и большой временной промежуток между появлением симптомов и госпитализацией. Тем не менее, увеличение риска было достаточно небольшим (отношение шансов около 1,03). Антикоагулянтная терапия была ассоциирована с более низким низком ТЭЛА.
- В исследовании, в которое были включены 2505 пациентов стационара (не находящиеся в ОРИТ), ВТЭ обнаружили в 3,6 % случаев (ТЭЛА в 2,2 % и ТГВ в 2,0 %) [34]. Диагностику проводили только при наличии симптомов.
- В более ранних исследованиях, в которых проводили диагностику у пациентов с соответствующими симптомами, ВТЭ находили с несколько более высокой частотой (приблизительно 3–6 %) [40,45]. У некоторых пациентов тромбы возникали в момент, когда они получали профилактическую антикоагулянтную терапию. В одном из исследований половина событий ВТЭ зарегистрирована в первые сутки после госпитализации, что свидетельствует о том, что тромбопрофилактика может быть неэффективной, поскольку ВТЭ уже произошла.
- В исследованиях, в которых диагностику проводили всем пациентам независимо от наличия симптомов, ВТЭ находили чаще. В другом исследовании 71 пациенту из нереанимационных отделений, госпитализированных с COVID-19 на период более 48 часов, при выписке проводилось дуплексное сканирование вен нижних конечностей, и ТГВ был выявлен с большей частотой (21 %) [46]. Только у двоих пациентов наблюдались явные симптомы ТГВ, у пяти пациентов были вовлечены обе нижние конечности. ТЭЛА была зарегистрирована у 10 % пациентов, один пациент умер. В другое исследование были включены 84 пациента из нереанимационных отделений, получавших антикоагулянтную терапию в профилактических дозах; авторы использовали компрессионную ультрасонографию вен нижней конечности для скрининга и обнаружили ТГВ в 12 % случаев [47].
Амбулаторные пациенты. Мы понимаем, что имеются зарегистрированные случаи тромбозов у амбулаторных пациентов с COVID-19, однако данные о заболеваемости недоступны на данный момент.
Артериальные тромбозы. Имеются данные и об артериальных тромбозах, в том числе и в ЦНС. В большом исследовании, в которые были включены 3334 пациента (829 из ОРИТ и 2505 из других отделений) инсульт зарегистрировали в 1,6 % и инфаркт миокарда в 8,9 % случаев [34]. Факторами риска артериального тромбоза стали пожилой возраст, мужской пол, латиноамериканское происхождение, коронарная недостаточность в анамнезе и высокий уровень D-димера (> 230 нг/мл) при поступлении в стационар. События артериального тромбоза были ассоциированы с повышенной смертностью (ОР 1,99; 95 % ДИ 1,65–2,40).
Результаты других исследований дополняют информацию по разным типам артериального тромбоза:
- Инсульт. В одной сети клиник за две недели было зарегистрировано пять случаев острого ишемического инсульта, ассоциированных с COVID-19, с симптомами окклюзии крупных артерий. Все пациенты были младше 50 лет [48]. До пандемии среди пациентов младше 50 лет за две недели в среднем регистрировалось всего 0,7 инсультов с окклюзией крупных артерий.
В одном из вышеупомянутых исследований пациентов ОРИТ ишемический инсульт произошел у трех пациентов из 184 (кумулятивная заболеваемость 3,7 %) [33]. В другом исследовании, которое уже обсуждалось ранее, церебральная ишемия была зарегистрирована у трех пациентов из 150 [17]. В исследовании, включающем 314 пациентов из нереанимационных отделений, у шести (2 %) случился ишемический инсульт. Ишемический инсульт был также зарегистрирован у трех пациентов в ОРИТ [45].
Артерии конечностей.В одном отчете описываются 20 пациентов одного лечебного учреждения с COVID-19 за трехмесячный период, у которых развилась острая ишемия конечностей [49]. По сравнению с показателями прошлого года, количество случаев резко возросло (16 % против 2 % в начале 2019 года). Большинство пациентов были мужского пола (18 из 20), средний возраст составлял 75 лет. Хирургическая реваскуляризация была проведена у 17 пациентов, только у 12 она прошла успешно (71 %), что оказалось ниже ожидаемого уровня успеха операций. Пациенты, которые получали гепарин после операции, не нуждались в повторном вмешательстве. При этом преимущества назначения гепарина в послеоперационный период не достигли статистически значимого уровня.
В другом отчете описывались четыре пациента с острым артериальным тромбозом конечностей, двое из которых были молодого возраста и с отсутствием сопутствующих заболеваний (53-летний мужчина, у которого развился тромбоз аорто-подвздошного сегмента, и 37-летний мужчина, у которого развился тромбоз плечевой артерии) [50]. Оба пациента получали НМГ в профилактических дозах, и у обоих был зарегистрирован очень высокий уровень D-димера (> 9000 нг/мл).
Также известны случаи инфаркта миокарда, однако они подробно не разбирались в доступных исследованиях серий случаев.
Тромбоз мелких сосудов. Тромбозы мелких сосудов легких были обнаружены на аутопсиях некоторых пациентов, умерших от COVID-19 [7,16,35,37] (см. раздел "ВТЭ" выше). В других отчетах были описаны аномалии перфузии легких, которые объясняли тромбоэмболической болезнью [51].
Механизм этих событий неясен и может включать гиперкоагуляцию, прямое повреждение эндотелия, активацию комплемента или другие процессы.
Поскольку более определенных данных, касающихся механизмов тромбозов или их терапии, нет, мы не рекомендуем специализированное тестирование на предмет тромботических микроангиопатий (исследование активности ADAMTS13 или компонентов системы комплемента) или специфическое лечение (плазмаферез, терапия, направленная на компоненты системы комплемента) вне исследований.
Кровотечения. Кровотечения у пациентов с COVID-19 случаются реже, чем тромбозы, однако также могут происходить (в основном на фоне антикоагулянтной терапии). Ниже представлены некоторые примеры.
- В подгруппе из 25 пациентов ОРИТ, исследованных на предмет неврологических нарушений, у одного были обнаружены признаки внутричерепного кровоизлияния вместе с ишемическими повреждениями [17]. У трех других пациентов из этого исследования также наблюдались геморрагические осложнения: у двоих были зарегистрированы внутричерепные кровоизлияния, связанные с травмой головы, а у одного – кровоизлияние, связанное с ЭКМО (см. ранее "Артериальные тромбозы").
- При исследовании пациентов с подозрением на гепарин-индуцированную тромбоцитопению (ГИТ), у трех из пяти пациентов, проходивших терапию парентеральным прямым ингибитором тромбина, случилось серьезное кровотечение [52].
Эти наблюдения подчеркивают важность назначения антикоагулянтной терапии только при наличии соответствующих показаний, а также в случае пациентов с подозрением на инсульт — определения его ишемической или геморрагической природы.
Обследование
Обследование пациентов с COVID-19 и нарушениями свертывания (подозреваемыми или доказанными) затруднено в связи с недостатком данных о том, какие клинические и лабораторные параметры пациентов с COVID-19 нуждаются в коррекции, и с рисками, связанными с проведением диагностических процедур визуализации у потенциально заразных пациентов с острым течением заболевания.
Общий подход изложен ниже, хотя лечащий врач может принимать иные решения на основе обследования пациента. Этот подход соответствует рекомендациям Международным сообществом тромбоза и гемостаза (ISTH), Американским обществом гематологии (ASH) и Американским кардиологическим обществом (ACC) [15,53,54].
Рутинные обследования для всех пациентов
Госпитализированные пациенты
- Общий анализ крови (ОАК) с определением числа тромбоцитов.
- Коагулограмма (ПТВ, АЧТВ).
- Фибриноген.
- D-димер.
Имеет смысл повторять исследования ежедневно, хотя допустимо делать это не так часто. Рекомендовано ориентироваться на общее состояние пациента, данные при поступлении и изменения показателей. Измерение уровня D-димера чаще одного раза в день не показано.
Как отмечалось выше, у пациентов с COVID-19 часто встречаются:
— повышение D-димера;
— повышение фибриногена;
— нормальные или немного удлиненные ПТВ и АЧТВ;
— легкая тромбоцитопения или тромбоцитоз, но может быть нормальное содержание тромбоцитов.
Если клинические проявления нарушений отсутствуют, мы не корректируем изменения показателей свертываемости. Однако эти показатели могут служить прогностическими факторами и влиять на принятие решения о необходимом уходе и терапии, направленных на лечении инфекции. К примеру, повышенный уровень D-димера ассоциирован с худшим прогнозом, особенно если речь идет об увеличении в несколько раз [55] (см. далее "Исследование новых подходов к лечению").
Атипичные значения показателей — удлинение АЧТВ (непропорциональное ПТВ), низкий фибриноген, значительная тромбоцитопения — предполагают наличие другого сопутствующего состояния и могут потребовать дальнейшего изучения (см. далее "Роль дополнительных исследований").
Мы не проводим рутинные исследования на наличие тромботической тромбоцитопенической пурпуры (ТТП), других тромботических микроангиопатий или антифосфолипидных антител (АФА). Транзиторное повышение АФА часто наблюдается при острых инфекционных заболеваниях и при отсутствии симптомов не имеет клинического значения ("Diagnosis of antiphospholipid syndrome", раздел "Other conditions associated with aPL").
Мы не проводим рутинный скрининг с помощью методов визуализации, так как не доказано, что это улучшает исходы. Кроме того, так большее количество медицинских работников подвергаются опасности. Проведение визуализации целесообразно у пациентов с симптомами (см. далее "Роль дополнительных исследований").
Амбулаторные пациенты. Проводить рутинные исследования системы гемостаза у амбулаторных пациентов не требуется. При наличии настораживающих симптомов следует проводить те же обследования, которые мы рекомендовали для госпитализированных пациентов (см. далее "Роль дополнительных исследований").
Роль дополнительных исследований
Диагностика ТГВ и ТЭЛА. Диагностика ТГВ и ТЭЛА может быть затруднена, так как симптомы ТЭЛА сходны с симптомами COVID-19, а визуализация не всегда возможна. Однако порог настороженности для диагностики ТГВ и ТЭЛА должен быть низким, так как у многих пациентов присутствуют факторы риска, и сами состояния встречаются часто. (см. раздел "ВТЭ" выше).
ТГВ. Пациентам с подозрением на ТГВ необходимо проводить компрессионное ультразвуковое исследование вен нижних конечностей, когда это возможно ("Clinical presentation and diagnosis of the nonpregnant adult with suspected deep vein thrombosis of the lower extremity").
ТЭЛА. Для диагностики ТЭЛА мы применяем следующие рекомендации Американского гематологического общества [56]:
- Нормального уровня D-димера (необычно для пациентов с COVID-19 в критическом состоянии) достаточно для исключения диагноза ТЭЛА. Повышение D-димера не является специфическим признаком ВТЭ и его не достаточно для постановки диагноза. (См. "Overview of acute pulmonary embolism in adults, раздел "Clinical presentation, evaluation, and diagnosis").
- У пациентов с подозрением на ТЭЛА (необъяснимая гипотензия, тахикардия, ухудшение респираторного статуса, наличие факторов риска тромбоза) КТ-ангиография легких является исследованием выбора. Вентиляционно-перфузионная сцинтиграфия (вентиляционно-перфузионное сканирование) — альтернативный метод исследования, когда КТ-ангиография не может быть выполнена или ее результаты нуждаются в уточнении, хотя сцинтиграфия может быть неэффективна в случаях существенного поражения легких при COVID-19. ("Clinical presentation, evaluation, and diagnosis of the nonpregnant adult with suspected acute pulmonary embolism").
Назначение терапевтических доз антикоагулянтов при неубедительных результатах КТ-ангиографии или вентиляционно-перфузионной сцинтиграфии обсуждается далее. (См. далее «Назначение терапевтических доз антикоагулянтов»).
При проведении радиологических исследований необходимо соблюдать все меры инфекционного контроля (см. "Коронавирусная болезнь 2019 (COVID-19): эпидемиология, вирусология и профилактика").
Обследования при нетипичных изменениях лабораторных показателей. Как уже отмечалось, типичные изменения лабораторных показателей у пациентов с COVID-19 нужно регулярно контролировать, они обладают прогностической значимостью (см. ранее «Рутинные обследования для всех пациентов»).
Обследование пациентов с нетипичными изменениями показателей (уровень тромбоцитов <50 тыс. ед/мкл, непропорциональное удлинение АЧТВ относительно ПТВ или значительное снижение уровня фибриногена) проводится по общим рекомендациям и обсуждается в отдельных разделах.
- Тромбоцитопения: "Approach to the adult with unexplained thrombocytopenia"
- Изменения показателей свертываемости крови: "Clinical use of coagulation tests, раздел Evaluation of abnormal results"
Обследование при кровотечении. Методы обследования обсуждаются отдельно ("Approach to the adult with a suspected bleeding disorder" и "Clinical use of coagulation tests, раздел "Patient on anticoagulant"). Тактика ведения зависит от причины кровотечения (см. далее "Лечение кровотечений").
Тактика ведения
Обзор тактики ведения. Ведение пациентов с гиперкоагуляцией связано с многочисленными трудностями. Повышенная свертываемость крови отрицательно влияет на прогноз, однако на сегодняшний момент нет исследований, поддерживающих использование дополнительных методов ведения пациентов, кроме стандартных, а антитромботическая терапия может вызвать кровотечения [57]. Поскольку нет общепринятых рекомендаций по ведению пациентов, лечебные учреждения могут сами выбирать степень интенсивности профилактических и лечебных мер. Включение пациентов в клинические исследования может улучшить подход к терапии [58,59,60].
Независимо от того, включены ли пациенты в клинические исследования, рекомендовано четкое следование протоколам медицинского учреждения и рекомендациям экспертов в области тромбоза и гемостаза. Это поможет сбалансировать риски тромбозов и кровотечений и позволит принять правильные решения о назначении противотромботической терапии. При кровотечениях, вызванных слишком высокими дозами антитромботической терапии, может потребоваться назначение протромботической терапии, а это приведет к еще большему повышению рисков тромбозов.
Временные руководства и часто задаваемые вопросы опубликованы следующими организациями:
- Международное общество тромбоза и гемостаза (ISTH) опубликовало указания по диагностике и ведению таких состояний [53,61,62];
- Форум по антикоагулянтам [63];
- Американское общество гематологии (ASH) [64];
- Американская коллегия кардиологии (ACC) [54].
Мы принимаем во внимание нехватку исследований и согласны с этими рекомендациями. Наш подход кратко изложен в таблице 1 и обсуждается далее. Как указано выше, удлинение АЧТВ в связи с появлением волчаночного антикоагулянта не означает снижение риска тромбоэмболических осложнений (в случае некоторых пациентов это означает даже увеличение риска) и не является причиной избегания применения антикоагулянтов. (См. выше "Нарушения свертываемости").
Вне зависимости от выбранного подхода клиницистам следует ознакомиться с данными о возможных взаимодействиях между пероральными антикоагулянтами и разрабатываемыми вариантами терапии COVID-19 [65,66].
Отдельно обсуждается ведение пациентов с нарушениями коагуляции, находящихся на ЭКМО ("Coronavirus disease 2019 (COVID-19): Critical care and airway management issues", раздел "Additional options" и "Extracorporeal membrane oxygenation (ECMO) in adults").
Пациентам с гепарин-индуцированной тромбоцитопенией (ГИТ) в анамнезе или в настоящее время не следует назначать НМГ или НФГ. Альтернативные варианты терапии обсуждаются отдельно (см. "Management of heparin-induced thrombocytopenia").
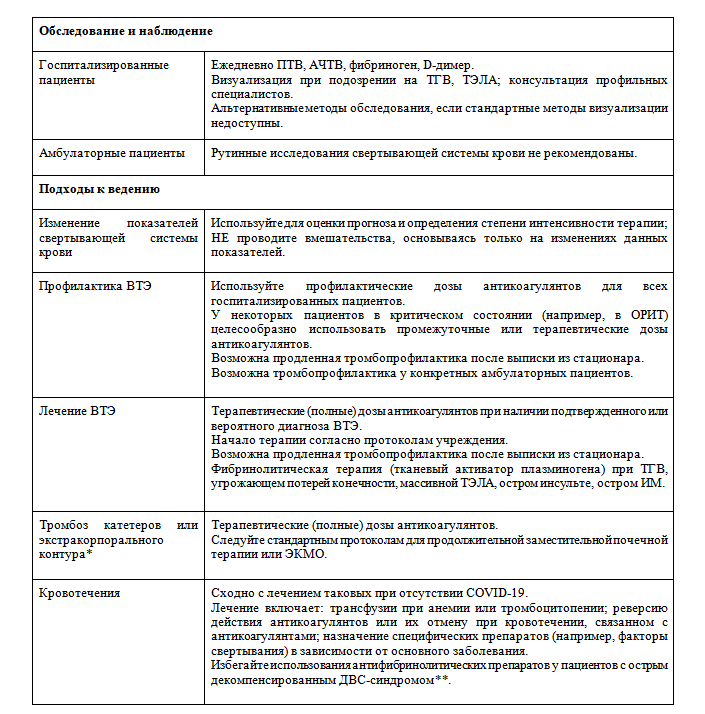
Таблица 1. Краткая справка по диагностике и лечению гиперкоагуляции, ассоциированной с COVID-19
*Включает непрерывную заместительную почечную терапию (гемодиализ), ЭКМО и другие экстракорпоральные контуры.
**Острый декомпенсированный ДВС-синдром ассоциирован с кровотечениями и/или тромбозами, удлинением ПТВ и АЧТВ, тромбоцитопенией, гипофибриногенемией. Следует избегать применения антитромботических препаратов (транексамовая кислота и аминокапроновая кислота), так как они могут спровоцировать развитие тромбоза.
Профилактика ВТЭ в условиях стационара
Показания. Имеет смысл проводить профилактику ВТЭ у всех пациентов, госпитализированных по терапевтическому, хирургическому или акушерско-гинекологическому профилям COVID-19 (см. Алгоритм 1) при отсутствии противопоказаний к назначению антикоагулянтов (активное кровотечение или тяжелое кровотечение в течение прошедших 24–48 часов) или гепарина (например, гепарин-индуцированная тромбоцитопения в анамнезе; в таких случаях следует отдавать предпочтение альтернативным препаратам, таким как фондапаринукс).
- Все пациенты с диагнозом COVID-19, находящиеся в ОРИТ, должны получать профилактическую антикоагулянтную терапию. Некоторые специалисты эмпирически используют средние или терапевтические дозы антикоагулянтов у пациентов в тяжелом состоянии без ВТЭ в анамнезе (см. далее "Возможная роль полных доз антикоагулянтов у пациентов в крайне тяжелом состоянии").
- Пациенты с COVID-19 терапевтического профиля (не в ОРИТ) должны получать профилактические дозы НМГ (или НФГ, если НМГ недоступен).
- Для пациентов COVID-19 хирургического профиля профилактика ВТЭ особенно важна в периоперативный период. Подробнее о выборе времени назначения и дозе написано в другом разделе ("Prevention of venous thromboembolism in adult orthopedic surgical patients" и "Prevention of venous thromboembolic disease in adult nonorthopedic surgical patients").
- Пациентам с COVID-19 акушерско-гинекологического профиля,поступившим до или после родов,рекомендованапрофилактика ВТЭ. НМГ можно назначать, если роды не ожидаются в ближайшие 24 часа, а также после родов; НФГ используется, если предполагается, что потребуется его скорая отмена: роды, нейроаксиальная анестезия или инвазивное вмешательство в ближайшие 12–24 часа или на 36–37 неделях беременности ("Coronavirus disease 2019 (COVID-19): Pregnancy issues, раздел "Hospitalized patients" и "Use of anticoagulants during pregnancy and postpartum").
Дозирование препаратов. Ниже перечислены рекомендованные дозы для подкожного введения, однако многие эксперты рекомендуют более высокие дозы для пациентов в крайне тяжелом состоянии, и особенно для тех, кто находится в ОРИТ (см. далее "Возможная роль полных доз антикоагулянтов у пациентов в крайне тяжелом состоянии"):
Эноксапарин — 40 мг 1 р/день (CrCl > 30 мл/мин); 30 мг 1 р/день (CrCl 15–30 мл/мин).
Европейская дозировка (в МЕ/кг) следующая [67]:
— низкоинтенсивная терапия — 100 МЕ/кг 1 р/день;
— терапия средней интенсивности — 70 МЕ/кг 2 р/день;
— высокоинтенсивная терапия — 100 МЕ/кг 2 р/день.
Далтепарин — 5000 ME 1 р/день.
Надропарин — 3800 или 4000 анти-Ха МЕ 1 р/день (вес ≤ 70 кг); 5700 МЕ 1 р/день (вес > 70 кг). В некоторых случаях допустимо использование до 50 анти-Ха МЕ/кг каждые 12 часов.
Тинзапарин — 4500 анти-Ха МЕ 1 р/день.
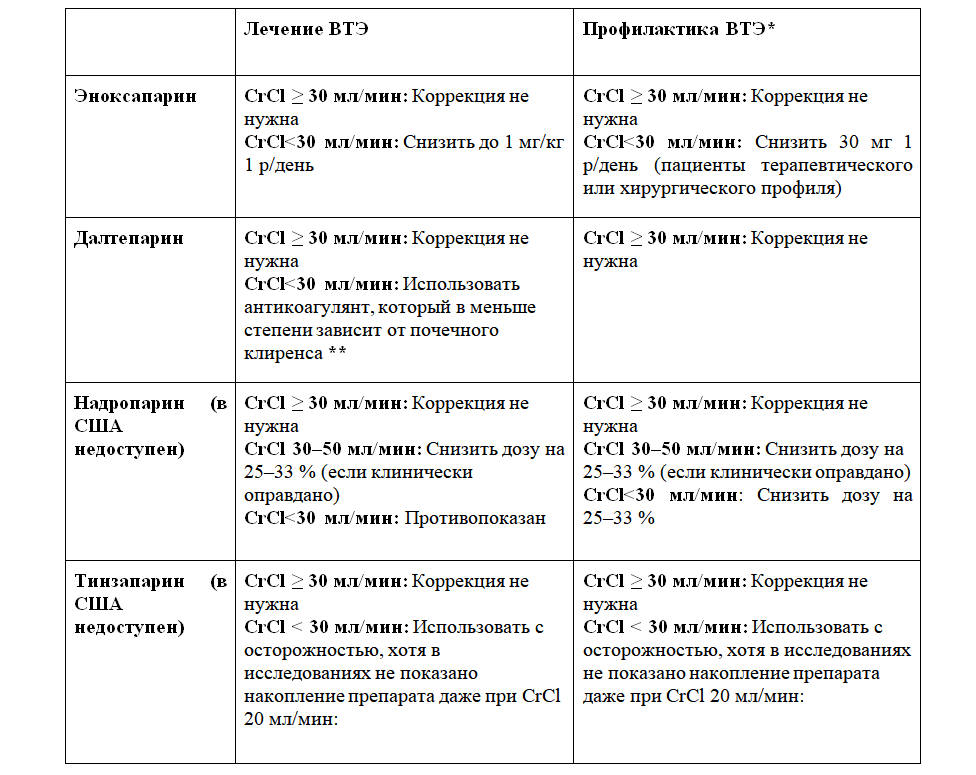
Для пациентов с CrCl < 15 мл/мин или находящихся на заместительной почечной терапии мы используем НФГ, который в меньшей степени зависит от выделительной функции почек. Дополнительная информация о коррекции доз у пациентов с нарушением функции почек (таблица 2), ожирением (таблица 3) и у беременных (таблица 4).
Таблица 2. Режим дозирования НМГ у взрослых пациентов с нарушением функции почек
Предполагаемые коррекции доз низкомолекулярных гепаринов у пациентов с почечной недостаточностью (дозировки для подкожного введения). Все препараты следует применять с осторожностью у всех пациентов с почечной недостаточностью, и все пациенты должны находиться под внимательным наблюдением: возможны кровотечения. Накопление препаратов может происходить после введения нескольких доз. Можно предпочесть альтернативные антикоагулянты, например, нефракционированный гепарин (особенно у пациентов с CrCl < 30 мл/мин, хронической болезнью почек или у пациентов на гемодиализе). Альтернативные препараты [1]: нефракционированный гепарин (НФГ); низкомолекулярный гепарин (НМГ) с более низким почечным клиренсом; прямые пероральные антикоагулянты (ПОАК) с низким почечным клиренсом (апиксабан, почечный клиренс около 25 %).
Прием НМК гепарина у пациентов с почечной недостаточностью связан с развитием гиперкалиемии. В других разделах UpToDаte обсуждается применение гепарина и НМК гепарина при определенных клинических состояниях, у младенцев и детей и при остром коронарном синдроме (ОКС) и инфаркте миокарда (ИМ) (для последних есть отдельные таблицы).
CrCl – клиренс креатинина, рассчитанный по формуле Кокрофта — Голта;
*Краткосрочная профилактика (до 10 дней). При более длительном применении необходим контроль анти-Ха активности во избежание накопления препарата.
**Согласно мнению некоторых экспертов, следует проверять уровень анти-Ха-факторной активности [2,3,4], однако в исследованиях не был установлен уровень скорректированных доз. Другие эксперты и рекомендации ASH 2018 года выступают против проверки анти-Ха-факторной активности и предлагают или корректировать дозы, ориентируясь на инструкцию к препарату, или перевести пациента на альтернативный антикоагулянт из числа приведенных выше. Активность препарата должна измеряться 4–6 часов после введения минимум 3–4 доз.Ниже приведены ожидаемые пиковые (спустя 4 часа после введения дозы) значения анти-Ха-факторной активности на терапевтических дозировках (для ВТЭ) (данные не прошли клиническую валидацию) [1,2]:
Эноксапарин 2р/день: 0,6–1,0 МЕ/мл (интервал 0,5–1,5 [5]) (по анти-Ха-факторной активности).
Эноксапарин 1р/день: >1,0 МЕ/мл (по анти-Ха-факторной активности).
Далтепарин 1р/день: 1,05 МЕ/мл (интервал от 0,5 до 1,5 [6]) (по анти-Ха-факторной активности).
Надропарин 1 р/день: 1,3 МЕ/мл (по анти-Ха-факторной активности) [7].
Тинзапарин 1р/день: 0,85 МЕ/мл (по анти-Ха-факторной активности) [8].
Ссылки
1. Witt DM, Nieuwlaat R, Clark NP, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: optimal management of anticoagulation therapy. Blood Advances 2018; 3257.
2. Garcia DA, Baglin TP, Weitz JI, Samama MM. Parenteral anticoagulants: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141:e24S.
3. Nutescu EA, Spinler SA, Wittkowsky A, Dager WE. Low-molecular-weight heparins in renal impairment and obesity: Available evidence and clinical practice recommendations across medical and surgical settings. Ann Pharmacother 2009; 43:1064.
4. Lexicomp Online. Copyright © 1978–2020 Lexicomp, Inc.
5. Enoxaparin sodium injection. US FDA approved prescribing information (revised October, 2013). Available at: accessdata.fda.gov.
6. Dalteparin sodium injection. US FDA approved prescribing information (revised May, 2019). Available at: accessdata.fda.gov.
7. Nadroparin calcium injection. Canada product monograph (revised January 2019). Available at: pdf.hres.ca.
8. Tinzaparin sodium injection. Canada product monograph (May 26, 2017). Available at: pdf.hres.ca.
Таблица 3. Дозировка НМГ у пациентов с ожирением
Все приведенные дозы рассчитаны для пациентов с сохранной функцией почек и предназначены для подкожного введения.
Тестирование на анти-Ха: Стабильные пациенты с весом до 144 кг (эноксапарин), до 190 кг (далтепарин***) или до 165 кг (тинзапарин) с ИМТ < 40 кг/м2 могут получать НМК гепарин для лечения ВТЭ в дозе, рассчитанной по весу, и при этом не проходить тестирование на анти-Ха [10]. В целом мы не рекомендуем проводить мониторирование анти-Ха. Можно рассматривать проведение мониторирования у пациентов с ИМТ>40 кг/м2, если они клинически нестабильны, у них развилось неожиданное тромбоэмболическое осложнение или кровотечение или им требуется длительное лечение ВТЭ.
* 1 мг эноксапарина ≈ 100 международных единиц (МЕ).
** Согласно инструкции по применению далтепарина, одобренной в США, фиксированная доза 18000 МЕ в день рекомендована для пациентов весом >99 кг для лечения ВТЭ, ассоциированной с онкологическими заболеваниями. Однако в рекомендациях указывается, что доза далтепарина должна рассчитываться по весу пациента [6]. Ограниченная доза 18000 МЕ в день не рекомендована.
*** Может понадобиться округление дозы в зависимости от особенностей препарата. См. подробности в базе данных Lexicomp. Эмпирическое увеличение дозы на 30 % для препаратов с фиксированной дозой для профилактики ВТЭ у пациентов с критическим ожирением основано на клиническом опыте и анализе фармакодинамики и данных о клинических исходах [6].
Ссылки
1. Deal EN, Hollands JM, Riney JN, et al. Evaluation of therapeutic anticoagulation with enoxaparin and associated anti-Xa monitoring in patients with morbid obesity: A case series. J Thromb Thrombolysis 2011; 32:188.
2. Lalama JT, Feeney ME, Vandiver JW, et al. Assessing an enoxaparin dosing protocol in morbidly obese patients. J Thromb Thrombolysis 2015; 39:516.
3. Scholten DJ, Hoedema RM, Scholten SE. A comparison of two different prophylactic dose regimens of low molecular weight heparin in bariatric surgery. Obes Surg 2002; 12:19.
4. Borkgren-Okonek MJ, Hart RW, Pantano JE, et al. Enoxaparin thromboprophylaxis in gastric bypass patients: Extended duration, dose stratification, and antifactor Xa activity. Surg Obes Relat Dis 2008; 4:625.
5. Enoxaparin sodium US prescribing information (revised October 2017) available at accessdata.fda.gov (Accessed on November 13, 2018).
6. Nutescu EA, Spinler SA, Wittkowsky A, et al. Low-molecular-weight heparins in renal impairment and obesity: Available evidence and clinical practice recommendations across medical and surgical settings. Ann Pharmacother 2009; 43:1064.
7. Dalteparin sodium injection US prescribing information (revised May 2017) available at accessdata.fda.gov (Accessed on November 13, 2018).
8. Tseng EK, Kolesar E, Handa P, et al. Weight-adjusted tinzaparin for the prevention of venous thromboembolism after bariatric surgery. J Thromb Haemost 2018; 16:2008.
9. Tinzaparin sodium injection Canada product monograph (revised May 2017) available at pdf.hres.ca (Accessed on November 13, 2018).
10. Garcia DA, Baglin TP, Weitz JI, et al. Parenteral anticoagulants: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (9th Edition). Chest 2012; 141:e24S.
Таблица 4. Режимы дозирования НМГ и НФГ у беременных
Приведенные дозировки применяются для беременных женщин, получающих профилактику ВТЭ. Терапевтические дозы относятся к дозам, используемым и для профилактики у пациентов с очень высоким риском, и для лечения ВТЭ. Данная таблица НЕ ДОЛЖНА применяться к женщинам с искусственными клапанами сердца. См. рекомендации UpToDate по использованию антикоагулянтов у беременных, где изложена детальная информация по ведению и мониторингу. См. рекомендации UpToDate, относящиеся к дозированию препаратов для конкретным групп беременных пациенток (например, пациентки с искусственными клапанами сердца, фибрилляцией предсердий, лечение ДВТ или ТЭЛА).
* Может потребоваться коррекция профилактических доз для крайних показателей веса; см. Таблицу 3 этого раздела.
** "Промежуточные" дозы, которые мы предлагаем, отличаются от приведенных в рекомендациях (Американской коллегия пульмонологов, АССР, и Американской коллегии акушеров и гинекологов, ACOG). Некоторые врачи используют другие "промежуточные" дозы: эноксапарин 40 мг п/к каждые 12 часов; это приводит к значительному увеличению инъекций.
Доказательства. Известно, что НМГ снижает риск ВТЭ и обладает противовоспалительным эффектом. В ретроспективном исследовании 2773 пациентов, госпитализированных с COVID-19, 786 (28 %) получали антикоагулянты; применение антикоагулянтов было связано с улучшением выживаемости пациентов, находящихся на интубации (71 % с антикоагулянтами против 37 % без антикоагулянтов) [68]. Интубированные пациенты сосавляли приблизительно 14 % всей выборки. В целом, антикоагулянтная терапия не была связана с улучшением выживаемости пациентов в больнице (78 % против 77 %). Кровотечение произошло у 3 % пациентов, получавших антикоагулянты и у 2 %, не получавших антикоагулянты (разница не является статистически значимой).
В ретроспективном исследовании 449 пациентов с COVID-19 в тяжелом состоянии применение эноксапарина (40–60 мг 1 р/день) было ассоциировано с увеличением выживаемости по сравнению с отсутствием фармакологической профилактики. Особенно был заметен эффект у пациентов с высоким уровнем D-димера [24].
- Разница в выживаемости была заметна только в подгруппе лиц с сепсис-индуцированными коагулопатиями (смертность в течение 28 дней, 40 % получали гепарин, 64 % — нет) или с высоким уровнем D-димера, однако не в когорте в целом.
- Положительный эффект был выше у пациентов с высокими уровнями D-димера. Снижение смертности достигло статической значимости при повышении D-димера в 6 раз по сравнению с верхним значением нормы (33 % против 52 %).
В одном небольшом исследовании у 16 пациентов были использованы более высокие профилактические дозы надропарина вместе с клопидогрелем. Ни одного случая ВТЭ не было зарегистрировано. Маленькая выборка и отсутствие контрольной группы, однако, ограничивают возможности интерпретации данного исследования [9].
Как сказано выше, ВТЭ наблюдались у высокого процента (25–43 %) лиц с COVID-19 в ОРИТ, несмотря на профилактические дозы антикоагулянтов. Таким образом, встает вопрос о назначении более высоких доз.
В одном исследовании отслеживались уровни антитромбина и при достижении низких значений назначался концентрат антитромбина [9]. Тем не менее, следует отметить, что мы не измеряем уровни антитромбина и не рассматриваем назначение концентрата антитромбина, если только у пациента нет наследственного дефицита антитромбина или наблюдается устойчивость к действию гепарина вместе с очень низкими уровнями антитромбина (см. "Antithrombin deficiency", раздел "Heparin resistance").
Показания к назначению терапевтических доз антикоагулянтов. Ниже приведены ситуации, в которых оправдано назначение терапевтических доз антикоагулянтов (например, эноксапарин 1 мг/кг каждые 12 часов) в случаев отсутствия противопоказаний в приему антикоагулянтов в целом (например, активное кровотечение или серьезное кровотечение в последние 24–48 часов) или конкретно к гепарину (например, гепарин-индуцированная тромбоцитопения в анамнезе, в случае чего необходимо использовать фондапаринукс) (Алгоритм 1).
Резистентность к гепарину (необходимы очень высокие дозы для достижения целевых значений АЧТВ или анти-Ха-факторной активности) может быть проблемой у пациентов c COVID-19. Авторы исследования серии случаев у 15 пациентов в ОРИТ отмечали очень высокую потребность в НФГ (8 из 10 пациентам требовалось более 35 тыс единиц в день) или НМГ (у 5 из 5 пациентов, получавших далтепарин, пиковая анти-Ха активность оказалась меньше ожидаемой, а именно < 0,6 МЕ/мл, если препарат назначен два раза в день, или < 1 МЕ/мл, если препарат назначен один раз в сутки) [69]. Причина резистентности к гепарину не до конца понятна. Авторы подчеркивают, что она не коррелирует с увеличением уровня фибриногена или фактора VIII или со сниженным уровнем антитромбина. Молекула гепарина имеет отрицательный заряд и может взаимодействовать с разнообразными положительно заряженными белками плазмы, некоторые из которых имеют свойства белков острой фазы. Эти белки связывают молекулу гепарина, тем самым внося вклад в устойчивость.
У пациентов, которые получают НФГ и изначально имели удлиненный АЧТВ или устойчивость к гепарину, не рекомендовано ориентироваться на АЧТВ. Вместо этого, для выбора дозировок следует отслеживать показатель анти-Ха-факторной активности [63]. Целевые уровни АЧТВ и анти-Ха-факторной активности указаны в таблице 5.
Таблица 5. Коррекция дозы НФГ у взрослых в зависимости от анти-Ха-факторной активности или* АЧТВ
Данная таблица является одним примером расчета дозы гепарина по весу, ориентируясь или на анти-Ха-факторную активность или на АЧТВ. Все дозировки основаны на весе пациента в килограммах. Начальные и последующие болюсные дозы и скорость инфузии основываются на показаниях к назначению гепарина (например, для острой венозной тромбоэмболии, инсульта, острого коронарного синдрома) и зависят от конкретного медицинского учреждения.
*Следует использовать только ОДИН из показателей (анти-Ха-факторная активность или АЧТВ); они редко совпадают.
**Целевые показатели АЧТВ зависят от реагентов и инструментов, которые используются в конкретной лаборатории и должны быть установлены отдельно для каждого конкретного лечебного учреждения.
Подтвержденная или предполагаемая ВТЭ. Терапевтические дозы (полные дозы) антикоагулянтов назначаются при подтвержденной ВТЭ, как и для пациентов без COVID-19. (См. выше: "Диагностика ТГВ и ТЭЛА").
Назначение полных терапевтических доз антикоагулянтов также имеет смысл в случае предполагаемой ВТЭ, когда стандартная диагностика недоступна или не может быть выполнена. Когда нет возможности провести КТ-ангиографию или вентиляционно-перфузионную сцинтиграфию, для начала лечения может быть достаточно:
- Подтверждения наличия ТГВ при компрессионном ультразвуковом исследовании вен нижних конечностей
- Трансторакальная эхокардиография или УЗИ, демонстрирующие продвижение тромба в легочной артерии
Когда нет возможности провести диагностические исследования, имеет смысл начинать эмпирическую терапию терапевтическими дозами антикоагулянтов, если:
- Происходит резкое ухудшение респираторного статуса у интубированного пациента, соответвующее ТЭЛА, особенно если нет изменений на рентгенограмме легких и в уровнях маркеров воспаления, а ухудшение не связано с кардиологическими причинами.
- Возникает необъяснимая дыхательная недостаточность (не по причине гиперволемии или ОРДС), особенно если уровни фибриногена и/или D-димера очень высокие.
- Данные объективного осмотра соответствуют тромбозу (поверхностный тромбофлебит или сетчатая пурпура, не объяснимая другими состояниями).
У пациентов с острой ВТЭ при выписке показано назначение длительной тромбопрофилактики.
Тромбоз внутрисосудистых катетеров. Антикоагулянты в терапевтических дозах назначают пациентам с повторными тромбозами внутрисосудистых катетеров (артериальные катетеры, центральные венозные катетеры), которые происходят несмотря на профилактику антикоагулянтами. Терапевтические дозы также назначают тем, у кого развиваются тромбозы экстракорпоральных контуров (непрерывная заместительная почечная терапия, ЭКМО). Детали обсуждаются в других разделах (см. "Coronavirus disease 2019 (COVID-19): Extracorporeal membrane oxygenation (ECMO)".
Возможная роль полных терапевтических доз антикоагулянтов у пациентов в крайне тяжелом состоянии. Неоднократно поднимался вопрос о применении терапевтических доз антикоагулянтов для профилактики тромбообразования у пациентов в критическом состоянии. (См. раздел "ВТЭ" выше.)
Многие крупные медицинские учреждения рекомендуют применение промежуточных доз или терапевтических доз у таких пациентов (см. "Коронавирусное заболевание 2019 (COVID-19): вопросы интенсивной терапии и обеспечения проходимости дыхательных путей", раздел "Предотвращение венозной тромбоэмболии").
Данные, сравнивающие различные уровни антикоагуляции (профилактические, промежуточные или терапевтические дозы) у тяжелобольных пациентов крайне ограничены. В небольшом рандомизированном исследовании (HESACOVID) 20 человек с тяжелой формой COVID-19 были рандомизированы для получения терапевтической дозы антикоагулянта (эноксапарин, 1 мг/кг дважды в день) или профилактической дозы антикоагулянта (эноксапарин, 40 мг один раз в день или нефракционированный гепарин, 5000 ЕД три раза в день) с учетом возраста, веса и функции почек [70]. Половина пациентов профилактической группы получали нефракционированный гепарин и половина — эноксапарин. Терапевтические дозы, по сравнению с профилактическими, привели к уменьшению количества дней на аппарате искусственной вентиляции легких и значительному снижению уровня D-димера. Однако уверенности в результатах мешает то, что исследование было неконтролируемым, а группа была небольшой. В настоящее время проводятся более масштабные клинические испытания, участие в таких исследованиях приветствуется.
По данным Американского гематологического общества (ASH) и Всемирной коллаборативной группы по изучению тромбозов при COVID-19 (Global COVID-19 Thrombosis Collaborative Group), применение терапевтических доз антикоагулянтов у пациентов без ВТЭ остается спорным, так как не хватает данных, которые могли бы подтвердить положительный эффект такой терапии. Также некоторые факторы риска ВТЭ являются одновременно факторами риска кровотечений [56,65]. Необходимо подтверждать предполагаемый диагноз ВТЭ, особенно у пациентов, не находящихся в ОРИТ. Подтверждение диагноза описывается в разделе выше (см. "Диагностика ТГВ и ТЭЛА").
Показания к назначению тканевого активатора плазминогена (tPA). Тканевый активатор плазминогена назначается по стандартным показаниям:
- ТГВ, угрожающий потерей конечности ("Catheter-directed thrombolytic therapy in deep venous thrombosis of the lower extremity: Patient selection and administration").
- Массивная ТЭЛА ("Approach to thrombolytic (fibrinolytic) therapy in acute pulmonary embolism: Patient selection and administration").
- Острый инсульт ("Approach to reperfusion therapy for acute ischemic stroke").
- Острый инфаркт миокарда ("Acute ST-elevation myocardial infarction: The use of fibrinolytic therapy").
По возможности рекомендуется проконсультироваться со специалистами по эмболии легких или специалистами по инсульту при принятии решений.
При этом мы не применяем тканевый активатор плазминогена у лиц с такими неспецифическими симптомами, как гипоксия или лабораторные свидетельства гиперкоагуляции.
В нескольких небольших исследованиях (3–5 пациентов) описано назначение tPA пациентам с ОРДС, ассоциированным с COVID-19, и в некоторых случаях наблюдали улучшение [71,72,73].
Профилактика тромбообразования у амбулаторных пациентов. Пациентам, выписанным из стационара с подтвержденным ВТЭ, требуется прием антикоагулянтов в течение минимум трех месяцев ("Overview of the treatment of lower extremity deep vein thrombosis (DVT)", раздел "Duration of therapy" и "Treatment, prognosis, and follow-up of acute pulmonary embolism in adults").
Некоторым пациентам без эпизода ВТЭ также требуется длительная тромбопрофилактика после выписки из стационара [65]:
— В связи с низкой частотой развития ВТЭ, несмотря на нечастое применение профилактического приема антикоагулянтов после выписки (согласно доступным исследованиям, некоторые из которых упомянуты ниже), мы не рекомендуем рутинную тромбопрофилактику после выписки;
— Мы рассматриваем тромбопрофилактику после выписки у пациентов с такими существенными протромботическими факторами риска, как ВТЭ в анамнезе, недавнее хирургическое вмешательство или травма, при отсутствии высокого риска кровотечения. Варианты профилактики после выписки включают препараты, использованные в клинических исследованиях, так как ривароксабан 10 мг ежедневно в течение 31–39 дней [74].
Риск ВТЭ после выписки представляется сходным с таковым для пациентов, госпитализированных в связи с острыми состояниями, отличными от COVID-19.
— В первом исследовании изучили 1877 пациентов выписанных после госпитализации по поводу COVID-19. Эти пациенты не получали тромбопрофилактику после выписки, и ВТЭ был диагностирован только у девяти человек (0,48 % или 4,8 на 1000 пациентов) [74]. Эта частота сходна с частотой ВТЭ в популяции до пандемии COVID-19 (56 событий на 18159 человек или 3,1 на 1000). Медианное значение интервала между выпиской и диагностикой ВТЭ составило 8 дней (3–33 дня).
— В другом исследовании изучили когорту из 163 пациентов, выписанных после госпитализации в связи с COVID-19, и обнаружили четыре события тромбоза (кумулятивная распространенность ВТЭ в течение 30 дней после выписки составила 0,6 %; кумулятивная распространенность всех видов тромбоза — 2,5 %); тромбопрофилактика после выписка проводилась только у 8 % пациентов [75]. В этом исследовании также зарегистрировали два события серьезного кровотечения (кумулятивный риск серьезного кровотечения 0,7 %).
Более подробно этот вопрос обсуждается в других источниках (см. "Prevention of venous thromboembolic disease in acutely ill hospitalized medical adults", раздел "Duration of prophylaxis").
Амбулаторные пациенты. Профилактика тромбообразования имеет смысл для амбулаторных пациентов, которые не были госпитализированы. Особенно это касается тех, у кого присутствуют факторы риска: ВТЭ в анамнезе, недавнее хирургическое вмешательство, травма, иммобилизация. Назначение профилактики таким пациентам основано исключительно на клинической оценке. Отсутствуют клинические исследования тромбопрофилактики у амбулаторных пациентов с COVID-19. Если принимается решение о проведении тромбопрофилактики у амбулаторных пациентов, мы используем ривароксабан 10 мг ежедневно 31–39 дней [74].
Лечение кровотечений. Кровотечения не являются проявлением COVID-19, однако могут происходить по другим причинам, например, вследствие травмы и/или лечения антикоагулянтами (см. "Кровотечения"). Подход к лечению кровотечений у пациентов с COVID-19 сходен с подходом у пациентов без COVID-19 и может включать реверсию действия антикоагулянтов и/или их отмену, трансфузии при тромбоцитопении или гипофибриногенемии или специфическую терапию, например, переливание корректоров плазменно-коагуляционного гемостаза.
- Кровотечения, связанные с приемом антикоагулянтов ("Management of warfarin-associated bleeding or supratherapeutic INR"; "Management of bleeding in patients receiving direct oral anticoagulants"; "Reversal of anticoagulation in intracranial hemorrhage").
- Травматическая коагулопатия ("Acute coagulopathy associated with trauma").
- Иммунная тромбоцитопения (ИТП), гемофилия, болезнь фон Виллебранда ("Immune thrombocytopenia (ITP) in adults: Initial treatment and prognosis"; "Treatment of bleeding and perioperative management in hemophilia A and B" и "Von Willebrand disease (VWD): Treatment of major bleeding and major surgery").
Антифибринолитические препараты (транексамовая кислота, аминокапроновая кислота) в основном не применяются у пациентов с ДВС-синдромом из-за риска тромбозов. По этой причине их следует избегать и у пациентов с COVID-19 ("Disseminated intravascular coagulation (DIC) in adults: Evaluation and management", раздел "Prevention/treatment of bleeding").
Фибриноген часто повышен у пациентов с COVID-19, и его дополнительное введение не требуется, кроме тех случаев, когда у пациентов происходит кровотечение, связанное с гипофибриногенемией или дисфибриногенемией (уровень активности фибриногена < 150–200 мг/дл) ("Disorders of fibrinogen", раздел "Treatment/prevention of bleeding").
Значение антиагрегантов. Изучение роли антиагрегантов еще продолжается [77,78]. Мы не назначаем антиагрегантную терапию при отсутствии традиционных показаний. Разумно продолжать терапию антиагрегантами, если таковая была назначена ранее в связи с другими показаниями, и использовать антиагрегантную терапию при наличии традиционных показаний к ней.
Исследование новых подходов к лечению. Сейчас идут исследования новых методов лечения COVID-19, и некоторые из них могут влиять на риск тромбозов. Эффект от новых видов терапии пока недостаточно изучен ("Коронавирусное заболевание 2019 (COVID-19): тактика ведения у взрослых пациентов", раздел "Специфическое лечение COVID-19"). Мы поддерживаем участие в клинических исследованиях, так как это необходимо для нахождения наиболее эффективных и безопасных мер по борьбе с осложнениями COVID-19. Применение новых подходов к лечению, которые находятся на стадии исследований, оправдано для пациентов в критическом состоянии. Уровень D-димера может быть использован как маркер отрицательного прогноза. Мы рекомендуем внимательное наблюдение за появлением клинических признаков тромбозов или кровотечений у всех лиц с COVID-19 и консультации экспертов по гемостазу и тромбозу в случаях ярко или необычно выраженных эффектов.
Рекомендации профессиональных сообществ. Ссылки на рекомендации профессиональных обществ и правительственные руководства некоторых стран и регионов мира представлены отдельно (см. "Society guideline links: Coronavirus disease 2019 (COVID-19) – International public health and government guidelines" и "Society guideline links: Coronavirus disease 2019 (COVID-19) – Guidelines for specialty care").
Выводы и рекомендации
Состояние гиперкоагуляции: при COVID-19 развивается состояние гиперкоагуляции, ассоциированное с воспалительными изменениями и изменениями лабораторных показателей, которые отличаются от таковых при ДВС-синдроме. Наблюдается значительное повышение уровня фибриногена и D-димера, умеренное удлинение ПТВ и АЧТВ и легкий тромбоцитоз или тромбоцитопения. Патофизиологические механизмы, лежащие в основе этих изменений, не до конца изучены. Возможно, вклад вносят факторы острого воспалительного ответа (см. "Патогенез").
Риск тромбоза: резко повышается риск ВТЭ, особенно у пациентов в ОРИТ. Исследования описывают распространенность ВТЭ 25–43 % среди пациентов в ОРИТ даже на фоне профилактических доз антикоагулянтов. Частота тромбоза сосудов микроциркуляторного русла также увеличивается. Риск событий артериального тромбоза, таких как инсульт, инфаркт миокарда и ишемия конечностей, также, по всей видимости, повышается (см. выше раздел "Клинические признаки").
Лабораторные исследования: всем пациентам, госпитализированным с COVID-19, необходимо проводить клинический анализ крови с подсчетом уровня тромбоцитов, ПТВ, АЧТВ, уровней фибриногена и D-димера. Частоту исследований следует определять, ориентируясь на клиническое состояние. Амбулаторным пациентам проведение этих исследований не требуется. Цель этих исследований — получить информацию о возможном течении заболевания и определения интенсивности терапии (см. "Рутинные обследования для всех пациентов").
Методы визуализации: целесообразно применение методов визуализации у пациентов с подозрением на ВТЭ. Если стандартные методы диагностики недоступны, можно использовать другие способы, чтобы принять решение о назначении терапевтических доз антикоагулянтов. Если наблюдаются изменения лабораторных показателей, не характерные для COVID-19, следует провести дополнительное обследование (см. "Роль дополнительных исследований").
Ведение пациентов: наш подход к ведению пациентов представлен в Таблице 1 и Алгоритме 1 и включает:
— тромбопрофилактику: при отсутствии противопоказаний всем пациентам необходимо проводить тромбопрофилактику при выборе терапии. Предпочтительно использовать НМГ, при тяжелых нарушениях функции почек или недоступности НМГ следует отдавать предпочтение НФГ. Протоколы некоторых учреждений включают более агрессивные подходы к применению антикоагулянтов: назначение промежуточных или даже терапевтических доз (см. "Профилактика ВТЭ в условиях стационара" и "Возможная роль полных доз антикоагулянтов у пациентов в крайне тяжелом состоянии"). Пациентам, у которых не было ВТЭ, рутинно не проводят тромбопрофилактику после выписку из стационара. У отдельных пациентов может быть установлен период тромбопрофилактики после выписки (см. выше "Амбулаторная тромбопрофилактика");
— лечение ВТЭ: терапевтические дозы антикоагулянтов назначаются для лечения ТГВ или ТЭЛА при отсутствии противопоказаний на срок не менее 3 месяцев (см. "Показания к назначению полных доз антикоагулянтов");
— кровотечения случаются редко. Лечение включает трансфузии, реверсию действия антикоагулянтов или их отмену, назначение специфических препаратов в зависимости от основного заболевания (см. "Лечение кровотечений");
— области неопределенности: мы активно поддерживаем включение пациентов в клинические исследования, так как это поможет найти самые эффективные и безопасные подходы к профилактике и лечению тромботических осложнений COVID-19. Некоторые из новых методов лечения могут влиять на риск тромбозов, однако в целом их эффект на систему свертываемости пока не изучен (см. "Исследование новых подходов к лечению").
Ссылки
- Teuwen LA, Geldhof V, Pasut A, Carmeliet P. COVID-19: the vasculature unleashed. Nat Rev Immunol 2020; 20:389.
- Lowenstein CJ, Solomon SD. Severe COVID-19 is a Microvascular Disease. Circulation 2020.
- Libby P, Lüscher T. COVID-19 is, in the end, an endothelial disease. Eur Heart J 2020; 41:3038.
- Middleton EA, He XY, Denorme F, et al. Neutrophil extracellular traps contribute to immunothrombosis in COVID-19 acute respiratory distress syndrome. Blood 2020; 136:1169.
- Hidalgo A. A NET-thrombosis axis in COVID-19. Blood 2020; 136:1118.
- Begbie M, Notley C, Tinlin S, et al. The Factor VIII acute phase response requires the participation of NFkappaB and C/EBP. Thromb Haemost 2000; 84:216.
- Magro C, Mulvey JJ, Berlin D, et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: A report of five cases. Transl Res 2020; 220:1.
- Panigada M, Bottino N, Tagliabue P, et al. Hypercoagulability of COVID-19 patients in intensive care unit: A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost 2020; 18:1738.
- Ranucci M, Ballotta A, Di Dedda U, et al. The procoagulant pattern of patients with COVID-19 acute respiratory distress syndrome. J Thromb Haemost 2020; 18:1747.
- Maier CL, Truong AD, Auld SC, et al. COVID-19-associated hyperviscosity: a link between inflammation and thrombophilia? Lancet 2020; 395:1758.
- https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31209-5/fulltext (Accessed on May 27, 2020).
- Medcalf RL, Keragala CB, Myles PS. Fibrinolysis and COVID-19: A plasmin paradox. J Thromb Haemost 2020.
- Hottz ED, Azevedo-Quintanilha IG, Palhinha L, et al. Platelet activation and platelet-monocyte aggregate formation trigger tissue factor expression in patients with severe COVID-19. Blood 2020; 136:1330.
- Allegra A, Innao V, Allegra AG, Musolino C. Coagulopathy and thromboembolic events in patients with SARS-CoV-2 infection: pathogenesis and management strategies. Ann Hematol 2020; 99:1953.
- https://www.hematology.org/covid-19/covid-19-and-coagulopathy (Accessed on April 20, 2020).
- Connors JM, Levy JH. Thromboinflammation and the hypercoagulability of COVID-19. J Thromb Haemost 2020; 18:1559.
- Helms J, Tacquard C, Severac F, et al. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med 2020; 46:1089.
- Wright FL, Vogler TO, Moore EE, et al. Fibrinolysis Shutdown Correlation with Thromboembolic Events in Severe COVID-19 Infection. J Am Coll Surg 2020; 231:193.
- Yin S, Huang M, Li D, Tang N. Difference of coagulation features between severe pneumonia induced by SARS-CoV2 and non-SARS-CoV2. J Thromb Thrombolysis 2020.
- Fogarty H, Townsend L, Ni Cheallaigh C, et al. COVID19 coagulopathy in Caucasian patients. Br J Haematol 2020; 189:1044.
- Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020; 18:844.
- Amgalan A, Othman M. Exploring possible mechanisms for COVID-19 induced thrombocytopenia: Unanswered questions. J Thromb Haemost 2020; 18:1514.
- Thachil J. The versatile heparin in COVID-19. J Thromb Haemost 2020; 18:1020.
- Tang N, Bai H, Chen X, et al. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost 2020; 18:1094.
- Mahévas M, Moulis G, Andres E, et al. Clinical characteristics, management and outcome of COVID-19-associated immune thrombocytopenia: a French multicentre series. Br J Haematol 2020.
- Lévesque V, Millaire É, Corsilli D, et al. Severe immune thrombocytopenic purpura in critical COVID-19. Int J Hematol 2020.
- Murt A, Eskazan AE, Yılmaz U, et al. COVID-19 presenting with immune thrombocytopenia: A case report and review of the literature. J Med Virol 2020.
- Bomhof G, Mutsaers PGNJ, Leebeek FWG, et al. COVID-19-associated immune thrombocytopenia. Br J Haematol 2020; 190:e61.
- Bowles L, Platton S, Yartey N, et al. Lupus Anticoagulant and Abnormal Coagulation Tests in Patients with Covid-19. N Engl J Med 2020; 383:288.
- Devreese KMJ, Linskens EA, Benoit D, Peperstraete H. Antiphospholipid antibodies in patients with COVID-19: A relevant observation? J Thromb Haemost 2020.
- Reyes Gil M, Barouqa M, Szymanski J, et al. Assessment of Lupus Anticoagulant Positivity in Patients With Coronavirus Disease 2019 (COVID-19). JAMA Netw Open 2020; 3:e2017539.
- Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol 2009; 145:24.
- Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 2020; 191:145.
- Bilaloglu S, Aphinyanaphongs Y, Jones S, et al. Thrombosis in Hospitalized Patients With COVID-19 in a New York City Health System. JAMA 2020; 324:799.
- Menter T, Haslbauer JD, Nienhold R, et al. Postmortem examination of COVID-19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings in lungs and other organs suggesting vascular dysfunction. Histopathology 2020.
- Wichmann D, Sperhake JP, Lütgehetmann M, et al. Autopsy Findings and Venous Thromboembolism in Patients With COVID-19: A Prospective Cohort Study. Ann Intern Med 2020; 173:268.
- Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med 2020; 383:120.
- Lax SF, Skok K, Zechner P, et al. Pulmonary Arterial Thrombosis in COVID-19 With Fatal Outcome : Results From a Prospective, Single-Center, Clinicopathologic Case Series. Ann Intern Med 2020; 173:350.
- Poissy J, Goutay J, Caplan M, et al. Pulmonary Embolism in Patients With COVID-19: Awareness of an Increased Prevalence. Circulation 2020; 142:184.
- Middeldorp S, Coppens M, van Haaps TF, et al. Incidence of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haemost 2020; 18:1995.
- Cui S, Chen S, Li X, et al. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost 2020; 18:1421.
- Nahum J, Morichau-Beauchant T, Daviaud F, et al. Venous Thrombosis Among Critically Ill Patients With Coronavirus Disease 2019 (COVID-19). JAMA Netw Open 2020; 3:e2010478.
- Llitjos JF, Leclerc M, Chochois C, et al. High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients. J Thromb Haemost 2020; 18:1743.
- Fauvel C, Weizman O, Trimaille A, et al. Pulmonary embolism in COVID-19 patients: a French multicentre cohort study. Eur Heart J 2020; 41:3058.
- Lodigiani C, Iapichino G, Carenzo L, et al. Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan, Italy. Thromb Res 2020; 191:9.
- Artifoni M, Danic G, Gautier G, et al. Systematic assessment of venous thromboembolism in COVID-19 patients receiving thromboprophylaxis: incidence and role of D-dimer as predictive factors. J Thromb Thrombolysis 2020; 50:211.
- Santoliquido A, Porfidia A, Nesci A, et al. Incidence of deep vein thrombosis among non-ICU patients hospitalized for COVID-19 despite pharmacological thromboprophylaxis. J Thromb Haemost 2020.
- Oxley TJ, Mocco J, Majidi S, et al. Large-Vessel Stroke as a Presenting Feature of Covid-19 in the Young. N Engl J Med 2020; 382:e60.
- Bellosta R, Luzzani L, Natalini G, et al. Acute limb ischemia in patients with COVID-19 pneumonia. J Vasc Surg 2020.
- Perini P, Nabulsi B, Massoni CB, et al. Acute limb ischaemia in two young, non-atherosclerotic patients with COVID-19. Lancet 2020; 395:1546.
- Patel BV, Arachchillage DJ, Ridge CA, et al. Pulmonary Angiopathy in Severe COVID-19: Physiologic, Imaging, and Hematologic Observations. Am J Respir Crit Care Med 2020; 202:690.
- Patell R, Khan AM, Bogue T, et al. Heparin induced thrombocytopenia antibodies in Covid-19. Am J Hematol 2020.
- Akima S, McLintock C, Hunt BJ. RE: ISTH interim guidance to recognition and management of coagulopathy in COVID-19. J Thromb Haemost 2020; 18:2057.
- https://www.acc.org/latest-in-cardiology/articles/2020/04/17/14/42/thrombosis-and-coronavirus-disease-2019-covid-19-faqs-for-current-practice.
- Zhang L, Yan X, Fan Q, et al. D-dimer levels on admission to predict in-hospital mortality in patients with Covid-19. J Thromb Haemost 2020; 18:1324.
- https://www.hematology.org/covid-19/covid-19-and-pulmonary-embolism (Accessed on April 24, 2020).
- Connors JM, Levy JH. COVID-19 and its implications for thrombosis and anticoagulation. Blood 2020; 135:2033.
- Ciavarella A, Peyvandi F, Martinelli I. Where do we stand with antithrombotic prophylaxis in patients with COVID-19? Thromb Res 2020; 191:29.
- Maldonado E, Tao D, Mackey K. Antithrombotic Therapies in COVID-19 Disease: a Systematic Review. J Gen Intern Med 2020; 35:2698.
- Iba T, Levy JH, Levi M, Thachil J. Coagulopathy in COVID-19. J Thromb Haemost 2020.
- Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost 2020; 18:1023.
- Spyropoulos AC, Levy JH, Ageno W, et al. Scientific and Standardization Committee communication: Clinical guidance on the diagnosis, prevention, and treatment of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haemost 2020; 18:1859.
- Barnes GD, Burnett A, Allen A, et al. Thromboembolism and anticoagulant therapy during the COVID-19 pandemic: interim clinical guidance from the anticoagulation forum. J Thromb Thrombolysis 2020; 50:72.
- https://www.hematology.org/covid-19/covid-19-and-coagulopathy.
- Bikdeli B, Madhavan MV, Jimenez D, et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-Up: JACC State-of-the-Art Review. J Am Coll Cardiol 2020; 75:2950.
- Testa S, Prandoni P, Paoletti O, et al. Direct oral anticoagulant plasma levels' striking increase in severe COVID-19 respiratory syndrome patients treated with antiviral agents: The Cremona experience. J Thromb Haemost 2020; 18:1320.
- Peyvandi F, Artoni A, Novembrino C, et al. Hemostatic alterations in COVID-19. Haematologica 2020.
- Paranjpe I, Fuster V, Lala A, et al. Association of Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized Patients With COVID-19. J Am Coll Cardiol 2020; 76:122.
- White D, MacDonald S, Bull T, et al. Heparin resistance in COVID-19 patients in the intensive care unit. J Thromb Thrombolysis 2020; 50:287.
- Lemos ACB, do Espírito Santo DA, Salvetti MC, et al. Therapeutic versus prophylactic anticoagulation for severe COVID-19: A randomized phase II clinical trial (HESACOVID). Thromb Res 2020; 196:359.
- Wang J, Hajizadeh N, Moore EE, et al. Tissue plasminogen activator (tPA) treatment for COVID-19 associated acute respiratory distress syndrome (ARDS): A case series. J Thromb Haemost 2020; 18:1752.
- Barrett CD, Oren-Grinberg A, Chao E, et al. Rescue therapy for severe COVID-19-associated acute respiratory distress syndrome with tissue plasminogen activator: A case series. J Trauma Acute Care Surg 2020; 89:453.
- Christie DB 3rd, Nemec HM, Scott AM, et al. Early outcomes with utilization of tissue plasminogen activator in COVID-19-associated respiratory distress: A series of five cases. J Trauma Acute Care Surg 2020; 89:448.
- https://www.hematology.org/covid-19/covid-19-and-vte-anticoagulation (Accessed on April 21, 2020).
- Roberts LN, Whyte MB, Georgiou L, et al. Postdischarge venous thromboembolism following hospital admission with COVID-19. Blood 2020; 136:1347.
- Patell R, Bogue T, Koshy A, et al. Postdischarge thrombosis and hemorrhage in patients with COVID-19. Blood 2020; 136:1342.
- DiNicolantonio JJ, Barroso-Aranda J. Harnessing adenosine A2A receptors as a strategy for suppressing the lung inflammation and thrombotic complications of COVID-19: Potential of pentoxifylline and dipyridamole. Med Hypotheses 2020; 143:110051.
- D'Souza R, Malhamé I, Teshler L, et al. A critical review of the pathophysiology of thrombotic complications and clinical practice recommendations for thromboprophylaxis in pregnant patients with COVID-19. Acta Obstet Gynecol Scand 2020.