Гистопатология и ультраструктурные изменения в материале аутопсий при COVID-19 в штате Вашингтон: серия клинических случаев

Оригинал: Histopathology and ultrastructural findings of fatal COVID-19 infections in Washington State: a case series
Автор: Benjamin T Bradley et al.
Опубликовано: Lancet, 16.07.2020
Перевод: Анна Селюта, ФГБУ НМИЦ онкологии им. Н.Н. Петрова, Фонд «Не напрасно!»
Редакция: Дарья Цыба, Фонд «Не напрасно!»
Аннотация
Введение
Коронавирус тяжелого острого респираторного синдрома-2 (SARS-CoV-2) является причиной продолжающейся пандемии и всё большего количества смертей по всему миру. До сегодняшнего дня данные о гистопатологических особенностях смертельных случаев заболевания, вызванного SARS-CoV-2 (COVID-19), были скудными из-за редкого проведения вскрытий и неполного забора образцов органов для гистологического исследования. Мы стремились предоставить клинико-патологический отчет о случаях тяжелого течения COVID-19, документируя гистопатологические изменения и доказательства тропности SARS-CoV-2 к определенным тканям.
Методы
В данную серию случаев были включены пациенты с положительным прижизненным или посмертным результатом теста на SARS-CoV-2. В отделениях медицинской экспертизы округов Кинг (Сиэтл, Вашингтон, США) и Снохомиш (Эверетт, Вашингтон, США) в условиях изоляторов с отрицательным давлением были проведены патологоанатомические исследования 14 человек, умерших от COVID-19 в феврале и марте 2020 г. Были рассмотрены клинические и лабораторные данные. Исследование тканей проводилось с помощью световой и электронной микроскопии, иммуногистохимических методов и количественной ОТ-ПЦР.
Результаты
Медиана возраста нашей когорты составила 73,5 года (42–84 года; IQR 67,5–77,25). Все пациенты имели клинически значимые сопутствующие заболевания, наиболее часто встречались артериальная гипертензия, хроническая болезнь почек, обструктивное апноэ сна и нарушения обмена веществ, включая диабет и ожирение. Основной находкой при анализе легких было диффузное альвеолярное повреждение в острой или организующейся фазе, у 5 пациентов были обнаружены очаговые легочные микротромбы. Коронавирусоподобные частицы были обнаружены в дыхательной системе, почках и желудочно-кишечном тракте. Лимфоцитарный миокардит наблюдался у одного пациента при обнаружении вирусной РНК в ткани сердца.
Обсуждение
Первичной патологией, наблюдаемой в нашей когорте, было диффузное альвеолярное повреждение с локализацией вируса в пневмоцитах и в эпителии трахеи. Были обнаружены редкие микротромбозы, эндотелиит не был выявлен. Хотя в других органах наблюдались признаки инфекционного поражения, их вклад в патогенез инфекции SARS-CoV-2 требует дальнейшего изучения.
Финансирование
Отсутствовало.
Результаты
Средний возраст нашей когорты составлял 73,5 года (42-84 года; IQR 67,5–77,25). Семь членов когорты были частью единого кластера из учреждения длительного ухода [13]. Все пациенты имели клинически значимые сопутствующие заболевания, наиболее распространенными из которых были артериальная гипертензия, хроническая болезнь почек, обструктивное апноэ сна и нарушения обмена веществ, включая диабет и ожирение (Таблица 1).
Наиболее часто встречающимися симптомами были респираторный дистресс, лихорадка и кашель. Реже встречались изменение психического статуса и желудочно-кишечные симптомы (тошнота, рвота или диарея). На момент госпитализации у 6 пациентов было острое повреждение почек с повышенным уровнем креатинина, у 3 пациентов были повышены тропонины крови. Дополнительные возбудители инфекций из дыхательных путей были выделены от 2 пациентов: у пациента N8 был грипп типа A и метициллин-чувствительный штамм Staphylococcus aureus (MSSA), а у пациента N7 посев мокроты был положительным на Pseudomonas aeruginosa. За исключением тех, кто отказался от реанимационных мероприятий (6 пациентов), все пациенты были интубированы. Пациент N12 был экстубирован в плановом порядке менее чем за сутки до смерти. Медиана времени от появления симптомов до интубации составила 3,5 дня (IQR 2–5; 8 пациентов), при этом большинство интубаций происходило при поступлении в приемный покой. Время до смерти после появления симптомов варьировало от 1 дня до 23 дней с медианой 7 дней (IQR 2–13).
У пациентов N8, N13 и N14 во время вскрытия брали свежую ткань для молекулярного и ультраструктурного исследования. Пациентка N8, женщина 76 лет, обратилась к врачу с жалобами на кашель и недомогание спустя 3 дня после возвращения из международного путешествия. При поступлении у больной была гипоксия с повышением тропонинов и лейкоцитозом. Рентген показал обширное двустороннее поражение легких, а микробиологический анализ был положительным на SARS-CoV-2, грипп типа A и метициллин-чувствительный S. aureus. У пациентки была повышенная потребность в кислороде, и она умерла через 7 дней после поступления. Пациент N13, 71-летний мужчина с длительным анамнезом сердечно-сосудистой патологии, терминальной стадией хронической болезни почек и хроническим фиброзом легких поступил с одышкой, делирием и впервые возникшей АВ-блокадой. С учетом респираторных симптомов и лимфопении, был взят тест на SARS-CoV-2, который оказался положительным. Через 4 дня после поступления у пациента развилась тяжелая гипоксия, за которой последовали внезапная остановка сердца и смерть. Пациентка N14, 73-летняя женщина, обратилась к врачу во время поездки за границу с жалобой на нарастающую в течение 2 дней одышку. При поступлении у нее был клинически значимый респираторный дистресс-синдром с гипоксией и признаки шока с повышенным содержанием лактата, лейкоцитозом и исходным нормальным уровнем тропонина. Рентген грудной клетки показал диффузное поражение легких, а тест на SARS-CoV-2 оказался положительным. Течение заболевания у пациентки осложнилось энцефалопатией, впервые выявленной фибрилляцией предсердий и предположительно вентилятор-ассоциированной пневмонией, она умерла на 21-й день от начала госпитализации.
У всех 7 умерших, подвергнутых стандартному вскрытию, были описаны тяжелые отечные легкие, в среднем 975 г для правого легкого и 700 г для левого легкого. Внутрипаренхиматозное кровотечение наблюдалось у пациента N6, а у пациента N14 — легочная консолидация. Объем плевральной жидкости сильно варьировал и составлял от 0 до 450 мл на плевральную полость. У пациентов N10 и N12 были признаки центральной легочной эмболии (см. рис.1). Спленомегалия наблюдалась у пациентов N8 и N13 (350 г и 505 г, соответственно), тогда как атрофия селезенки наблюдалась у пациента N13 (63 г). В мозге пациента N8 наблюдались рассеянные точечные субарахноидальные кровоизлияния. Дополнительно были обнаружены и другие изменения, включая различные степени поражения сердца, атеросклероз, признаки первичного сморщивания почек, застой в печени у большинства пациентов. Вес органов и макроскопические наблюдения доступны в приложении (стр. 1).
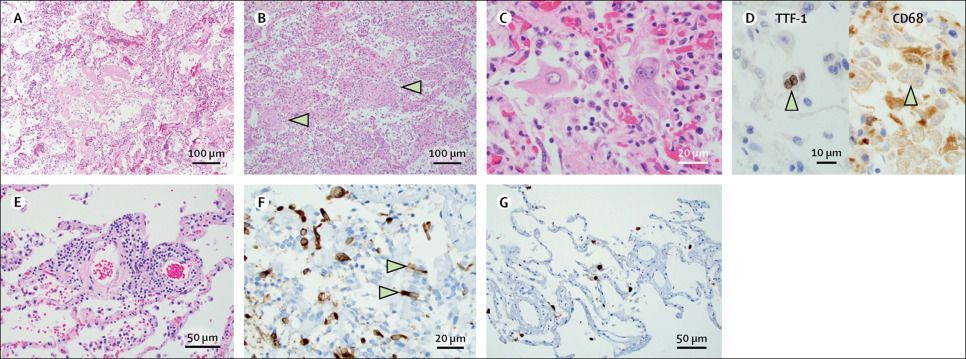
Гистопатологическое исследование легочной системы выявило диффузное альвеолярныое повреждение у 12 (86%) из 14 пациентов, о чем свидетельствовало наличие внутриальвеолярного фибрина, гиалиновых мембран или рыхлой организующейся соединительной ткани в межальвеолярных перегородках. У 11 (92%) из 12 пациентов с диффузным альвеолярным повреждением оно имело острый или острый и организующийся характер (рис. 2А, В). У пациента N2 наблюдали только организующееся диффузное повреждение альвеол. Дыхательные пути и альвеолярные пространства содержали большие реактивные многоядерные клетки, которые окрашивались положительно на эпителиальный маркер TTF-1 и отрицательно на маркер макрофагов CD68 (рис. 2C, D). Микроскопическое кровоизлияние на фоне диффузного альвеолярного повреждения было идентифицировано у пациентов N7, N11 и N13. У большинства пациентов наблюдалась разная степень хронического интерстициального воспаления, у некоторых была более выраженная периваскулярная лимфоцитарная воспалительная инфильтрация (рис. 2E). Области нейтрофильной воспалительной инфильтрации встречались часто: у 9 пациентов обнаруживалось, по крайней мере, очаговое бронхиальное или бронхиолярное воспаление, включая 3 пациентов с острой бронхопневмонией. Достоверных признаков васкулита или эндотелиита выявлено не было. Фоновые хронические заболевания легких в виде эмфизематозных изменений наблюдались у пациентов N3, N6 и N10, а у пациента N13 был обширный хронический интерстициальный фиброз. Иммуногистохимическое окрашивание на спайк-белок SARS-CoV-2 проводили на срезах легких пациентов N8, N10, N11 и N12. Иммунопозитивные клетки присутствовали в разном количестве, но наблюдались во всех исследуемых образцах. Иммуногистохимическое окрашивание на SARS-CoV-2 выявило альвеолоциты вместе с отслоившимся мерцательным респираторным эпителием в бронхиолах (рис. 2F, G).
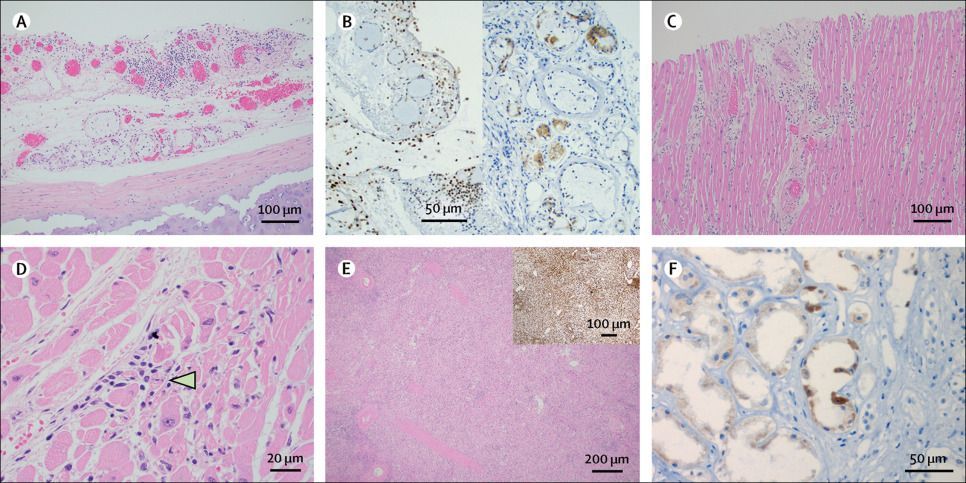
Оценка слизистой оболочки трахеи у большинства пациентов была ограничена посмертным слущиванием эпителиальных клеток. Однако наблюдались легкие воспалительные изменения подслизистой оболочки, типичным маркером которых является отек с небольшими скоплениями лимфоцитов (рис.3А). У пациента N8 иммуногистохимическое исследование на SARS-CoV-2 показало положительный результат в подслизистых железах и лимфоцитах (рис. 3B). Еще 4 пациента имели очаговый острый трахеит.
Изменения в сердце в основном были неспецифическими и связаны с ранее существовавшими сопутствующими заболеваниями. Наиболее часто наблюдались фиброз (у 14 [100%] пациентов) и гипертрофия кардиомиоцитов (у 13 [93%] пациентов). У пациента N8 имел место миокардит со скоплением лимфоцитов вокруг некротизированных миоцитов (рис. 3C, D). Иммуногистохимическая реакция на S-белок SARS-CoV-2 была отрицательной у пациента N8. Амилоид был идентифицирован в мелких сосудах у пациента N7 и в миокарде у пациента N13.
У пациентов N5, N9 и N12 наблюдалось истощение белой пульпы селезенки, что было подтверждено иммуногистохимический реакцией на CD45 у пациента N9 (рис. 3E). У пациента N8 был обнаружен небольшой инфаркт селезенки размером менее сантиметра. В субкаринальных лимфатических узлах наблюдалась нормальная фолликулярная архитектура с гемофагоцитозом, наблюдаемым у пациентов N8, N11 и N14. Иммуногистохимическая реакция на SARS-CoV-2 была отрицательной в субкаринальном лимфатическом узле пациента N12 и селезенке пациента N10. Лимфоидная ткань других пациентов была не доступна для тестирования.
В почках были обнаружены артерионефросклероз от легкой до тяжелой степени и диабетическая нефропатия. Несмотря на признаки аутолиза, у 11 пациентов были выявлены изменения, указывающие на острое повреждение почечных канальцев, включая обширную вакуолизацию канальцевого эпителия. У пациента N14 имелось хроническое воспаление паренхимы почек и очаговый сегментарный гломерулосклероз. Иммуногистохимическое исследование на SARS-CoV-2 у пациентов N8 и N10 показало неоднородное гранулярное цитоплазматическое окрашивание эпителиальных клеток почечных канальцев (рис. 3F). Вирус не был визуализирован в эндотелиальных клетках или клубочках иммуногистохимическим методом.
Патологические изменения в печени имели преимущественно хронический характер с различной степенью острого застоя и были обусловлены ранее существовавшими сопутствующими заболеваниями. Центрилобулярный некроз, соответствующий гипоперфузионному повреждению, был выявлен у 4 пациентов (N3, N8, N12 и N14). Воспаление печени не было выраженным, хотя у некоторых пациентов наблюдалась легкая перипортальная лимфоцитарная воспалительная инфильтрация. Слабая иммуногистохимическая реакция на SARS-CoV-2 в печени была неотличима от фона. Образцы щитовидной железы, гипофиза, надпочечников и поджелудочной железы практически не имели примечательных характеристик. Посмертный аутолиз препятствовал тщательному исследованию гастроинтестинальной системы и проведению иммуногистохимической реакции на SARS-CoV-2.
Исследование головного мозга было проведено у пяти пациентов (N1, N8, N10, N11 и N12). Пациент N8 имел острые патологические изменения с разбросанными точечными субарахноидальными кровоизлияниями и редкими микрокровоизлияниями в ствол головного мозга. В остальном невропатологические исследования не выявили значимых особенностей.
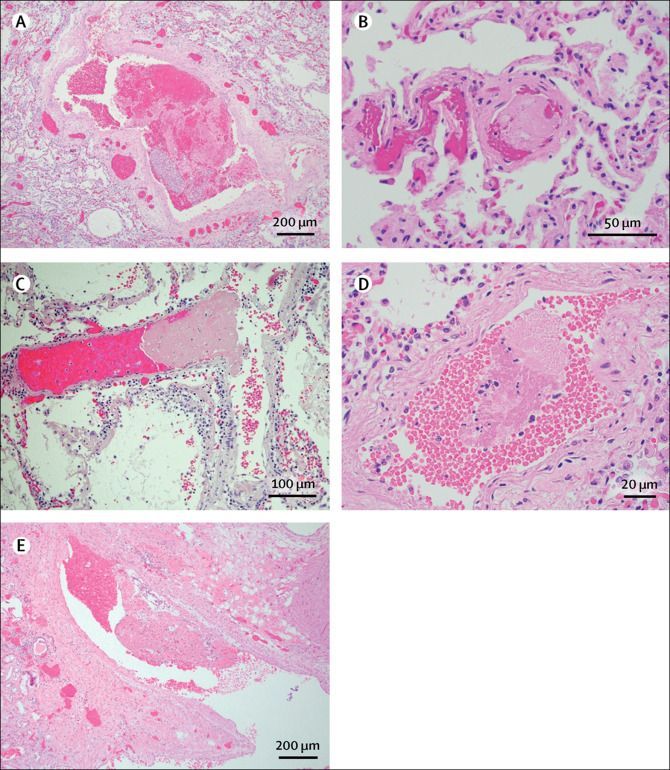
Очаговые легочные микротромбозы были выявлены у 5 пациентов (N3, N8, N9, N13, N14; рис. 4). Пациенты N3 и N9 также имели микротромбы в трахее, хотя у пациента N3 они были расценены как связанные с наличием постоянной трахеостомы. Организующийся тромб был найден в небольшой почечной вене у пациента N13. Микроскопическое поражение при видимой макроскопически легочной эмболии было отмечено у пациентов N10 и N12. Патологические данные для отдельных пациентов представлены в таблице 2.
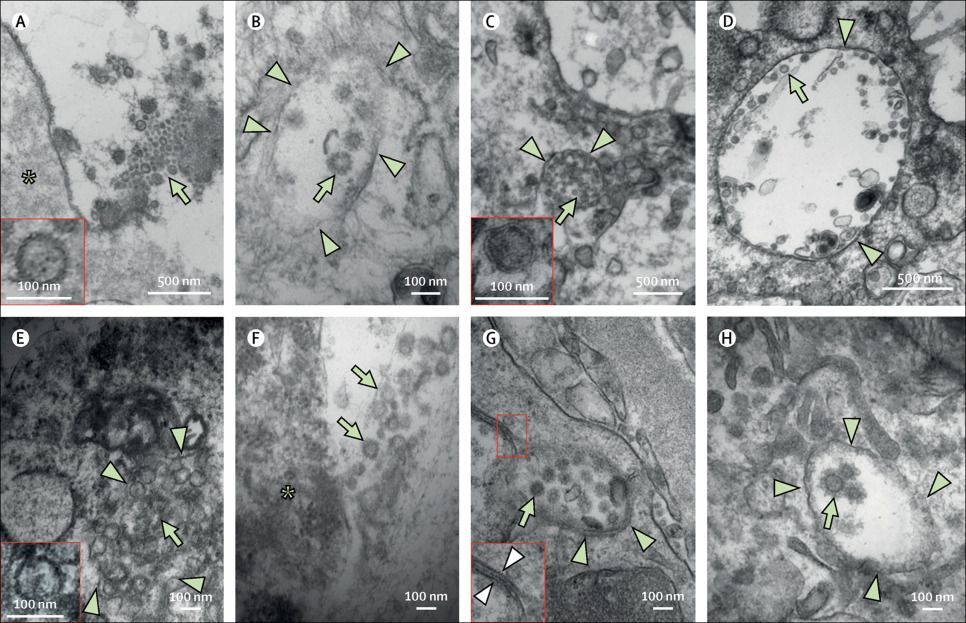
С помощью электронной микроскопии в легких, трахее, почках и толстой кишке пациентов N8 и N13 были выявлены агрегаты однородных частиц с круглой оболочкой размером от 70 до 100 нм с периферическими шиповидными выступами, соответствующими морфологии, описанной для SARS-CoV-2 [14, 15]. В случае локализации в пределах везикул или при нахождении во внеклеточном пространстве структуры с такими характеристиками были обозначены как коронавирусоподобные частицы. Для простоты мы называем эти частицы «вирусными». Вирусные частицы присутствовали как внутри эпителиальных клеток трахеи, так и во внеклеточном пространстве, прилегающем к клеточной мембране, и во внутрипросветной слизи (рис. 5А, В). В легком наблюдалось обширное слущивание пневмоцитов в альвеолярные пространства. Некоторые из этих пневмоцитов содержали большое количество аутофагосом, а иногда внутри везикул обнаруживались вирусные частицы. Вирусные частицы наблюдались как в пневмоцитах 2-го, так и 1-го типа (рис. 5C, D). В энтероцитах также были обнаружены скопления вирусных частиц, однако мембраны окружающих везикул часто были повреждены, а в образцах присутствовали посмертные артефакты (рис. 5E, F). В почках вирусные частицы наблюдались в эпителиальных клетках канальцев и, реже, в эндотелиальных клетках (рис. 5G, H). Некоторые вирусные частицы были связаны с двойными мембранами и напоминали везикулы с двойной мембраной (рис. 5G) [16]. Редкие плохо очерченные округлые частицы также наблюдались в подоцитах. В других исследованных органах, включая сердце, селезенку и печень, вирусные частицы не были выявлены.
РНК SARS-CoV-2 была обнаружена в легких, трахее, субкаринальных лимфатических узлах, почках, толстой кишке и селезенке у 3 из 3 протестированных пациентов (N8, N13 и N14). Вирусная РНК была также обнаружена в печени, сердце и крови пациентов N8 и N13. У всех исследованных пациентов в образцах легких и трахеи наблюдались самые низкие пороговые значения циклов репликации при ОТ-ПЦР.
Обсуждение
Спектр патологических изменений, наблюдаемых у людей, умерших от COVID-19, только начинает проясняться [9, 10, 11, 12]. Мы представляем серию случаев аутопсии 14 пациентов, умерших от COVID-19. Наши результаты показывают центральную роль повреждения легких и предоставляют доказательства, свидетельствующие о внелегочных поражениях SARS-CoV-2 при тяжелом течении инфекции.
Основным гистопатологическим наблюдением в нашей серии пациентов, умерших от COVID-19, было диффузное повреждение легких по типу альвеолярного повреждения в острой или организующейся фазе (12 [86%] из 14 пациентов). В легочной ткани большинства умерших обнаружены отек, реактивные пневмоциты 2-го типа, внутриальвеолярный фибрин и гиалиновые мембраны. Эти результаты аналогичны изменениям, описанным во время вспышки SARS-CoV в 2002–2003 годах и в последних исследованиях COVID-19 [9, 11, 17, 18, 19]. В отличие от инфекции, вызванной SARS-CoV, при которой организация диффузного альвеолярного повреждения преимущественно наблюдалась у пациентов при длительной госпитализации (>10–14 дней), мы обнаружили доказательства организации диффузного альвеолярного повреждения у пациента с COVID-19, который умер через 2 дня после появления симптомов (пациент N2), и наблюдали острое и организующееся диффузное альвеолярное повреждение у пациентов N8 и N11, которые умерли в течение недели от момента появления симптомов [20]. По сравнению с исследованием Franks et al. [20], у нашей когорты пациентов также был более короткий интервал от момента появления симптомов до смерти (медиана 7 дней против 12,3 дней). Мы предполагаем, что имел место субклинический период, в течение которого у пациентов с COVID-19 с диффузным поражением альвеол, умерших через неделю от начала появления симптомов, происходило повреждение легких. Гипотеза о том, что повреждение легких может произойти у пациентов с COVID-19 до появления симптомов, подтверждается обнаружением изменений в легких по данным компьютерной томографии у бессимптомных пациентов [21]. Эти результаты могут иметь значение для скрининга при поступлении в стационар для выявления и активного лечения пациентов с преждевременным развитием диффузного альвеолярного повреждения. Кроме того, мы отметили в основном очаговую иммуногистохимическую реакцию на SARS-CoV-2 в легких исследуемых пациентов. В областях с менее выраженным диффузным альвеолярным поражением вирус легче визуализировался в пневмоцитах. Отсутствие сильного диффузного окрашивания на частицы вируса может указывать на то, что большая часть цитотоксического повреждения, вызванного SARS-CoV-2, происходит на ранней стадии инфекции, а диффузное альвеолярное повреждение проявляется позже, как часть избыточного иммунного ответа хозяина.
Вопрос о том, подвергаются ли пациенты с COVID-19 повышенному риску повреждения эндотелия с формированием легочных микротромбозов, стал центральным в обсуждении тактики ведения пациентов [22]. Данная теория основана на наблюдаемом несоответствии между растяжимостью легочной ткани и насыщением кислородом у пациентов, находящихся на ИВЛ [23]. Эти результаты привели к предположению, что острый респираторный дистресс-синдром (ОРДС) при COVID-19 может представлять собой новый тип повреждения легких. В более раннем патологическом отчете по материалам 3 пациентов с COVID-19 были описаны активный эндотелиит и эндотелиальные клетки, содержащие коронавирусоподобные частицы, что подтверждает заявления о повреждении сосудов микроциркуляторного русла во время течения инфекции [15]. Однако высказывание о поражении вирусом эндотелиальных клеток было поставлено под сомнение [24]. Наши результаты документально подтверждают наличие коронавирусоподобных частиц в эндотелиальных клетках почек, однако мы не наблюдали поражения эндотелиальных клеток в других органах, исследованных с помощью электронной микроскопии или иммуногистохимии. Кроме того, в нашей когорте не наблюдалось гистологических свидетельств эндотелиита. Учитывая немногочисленность этих результатов, мы предполагаем, что повреждение легких, наблюдаемое в нашей когорте, представляет собой типичный фенотип легких с ОРДС, а не новый тип повреждения.
Предполагается, что поражение эндотелиальных клеток SARS-CoV-2 вызывает нарушение регуляции системы свертывания крови, что особенно влияет на мелкие сосуды и приводит к легочным микротромбозам и изменению дыхательных паттернов у интубированных пациентов [22, 23]. У 5 пациентов (примерно треть нашей когорты) микротромбы образовывались нечасто. Поскольку не существует формальной шкалы оценки степени тяжести микротромбозов в тканях, мы бы классифицировали присутствие микротромбов в нашей когорте как менее одного на поле с малым увеличением (10×) и в рамках того, что наблюдается при других причинах диффузного альвеолярного поражения. Большинство микротромбов было обнаружено при проведении полной аутопсии, и мы подозреваем, что редкие микротромбы также могут присутствовать в нашей когорте ограниченных аутопсий. Однако маловероятно, что этот фактор изменил бы наши общие выводы или окончательную причину смерти. Макроскопические тромбы в легочной артерии были выявлены у 2 пациентов (N10 и N12). У пациента N10 тромб прилегал к стенке легочной артерии и наблюдались признаки его организации, что указывает на тромбоэмболию, которая, вероятно, предшествовала инфекции COVID-19. Организующийся тромб был также обнаружен в небольшой почечной вене при микроскопическом исследовании пациента N13 и считался, вероятно, не связанным с инфекцией COVID-19.
Поражение сердца при COVID-19 является обычным явлением, хотя наши результаты не предоставляют прямых доказательств повреждения миокарда SARS-CoV-2. При исследовании течения инфекции у пациентов в отделении интенсивной терапии в Киркленде, штат Вашингтон, у 25–33% пациентов была выявлена кардиомиопатия неясного генеза. Предыдущие патологоанатомические исследования выявили вирусную РНК в ткани сердца одного пациента, хотя гистопатологических свидетельств миокардита не было [10]. В нашей когорте пациенты N8, N11 и N13 имели повышенный уровень тропонина, однако только у пациента N8 был гистологически подтверждён лимфоцитарный миокардит. В миокарде этого пациента с помощью ПЦР была выявлена вирусная РНК, но результаты иммуногистохимии и электронной микроскопии были отрицательными. Поскольку у пациента также была виремия, низкий уровень РНК, обнаруженный в ткани сердца, мог свидетельствовать о циркуляции вируса, а не о прямом поражении миокарда. У пациента N8 перед смертью был положительный результат теста на грипп типа A, что также могло стать причиной вирусного миокардита [26]. Контаминация образцов вирусной РНК также может объяснить результаты исследования печени и селезенки, где вирус не был идентифицирован с помощью электронной микроскопии или иммуногистохимии.
Эпителиальные клетки почечных канальцев, эндотелиальные клетки и подоциты экспрессируют ACE2, что делает почки потенциальной мишенью для инфекции SARS-CoV-2 [27]. Прямое поражение почечных клеток вирусом было предложено в качестве механизма острого повреждения почек, наблюдаемого при COVID-19 [28]. В двух исследованиях сообщалось о наличии SARS-CoV-2 в эпителиальных клетках канальцев и подоцитах [14, 15]. В этих исследованиях изучались ультраструктурные характеристики, что несёт в себе риск путаницы с клеточными структурами при использовании методов без иммунных меток. Таким образом, мы обозначили наблюдаемые структуры как «коронавирусоподобные частицы», хотя положительные данные ПЦР (3 из 3 пациентов) и иммуногистохимических исследований (2 из 4 пациентов) подтверждают наше утверждение о том, что при COVID-19 происходит поражение почечных клеток.
Множественные ортогональные подходы, включая ПЦР, иммуногистохимию и электронную микроскопию, были использованы для идентификации тканей, содержащих вирусные частицы. Характер распространения вируса, наблюдаемый в нашей когорте, поднимает вопросы о механизме распространения вируса во время тяжелого течения инфекций, особенно о том, может ли SARS-CoV-2 переноситься лимфоцитами. Текущие данные подтверждают эту гипотезу: вирусная РНК обнаружена в образцах крови, а данные in vitro показывают, что псевдотип SARS-CoV-2 способен поражать лимфоциты [6, 29]. В нашем исследовании 2 из 3 образцов цельной крови и 3 из 3 лимфатических узлов дали положительный ПЦР-результат на SARS-CoV-2, в дополнение к иммуногистохимическому выявлению лимфоцитов в подслизистой оболочке трахеи пациента N8. Если SARS-CoV-2 способен вызывать продуктивную инфекцию в лимфоцитах, это может служить объяснением плохой выживаемости и цитокиновых нарушений при тяжелом течении COVID-19 с лимфопенией [30].
Остаётся неясным, в какой степени полученные нами данные о внелегочных поражениях SARS-CoV-2 распространяются на случаи нетяжелого течения COVID-19. Поскольку SARS-CoV-2 был обнаружен в моче и стуле пациентов с нетяжелым течением COVID-19, вероятно, продуктивная инфекция может развиваться вне легких [7, 31]. Эти вопросы вызывают беспокойство при ведении пациентов из групп повышенного риска, в том числе с хронической болезнью почек или воспалительными заболеваниями кишечника. Необходимо внимательно следить за тем, подвержены ли эти пациенты повышенному риску более серьезных осложнений во время инфекции SARS-CoV-2. Еще одна группа пациентов, требующая тщательного наблюдения — это пациенты, перенесшие трансплантацию органов. Хотя внелегочная инфекция может быть менее распространена при легком или субклиническом течении болезни, неясно, может ли активная внелегочная инфекция существовать у пациента без сопутствующей респираторной инфекции.
Наше исследование имеет несколько ограничений. Электронная микроскопия была ограничена исследованием образцов пациентов N8 и N13, ПЦР — пациентов N8, N13 и N14, а иммуногистохимическое тестирование — пациентов N8, N10, N11 и N12. Будущие исследования покажут, подтверждаются ли эти относительно последовательные результаты на более крупных выборках. Поскольку эпидемические ограничения, действующие в течение февраля и начала марта 2020 года, не позволили провести полное вскрытие 7 пациентов, мы были ограничены в возможности обнаружения редких изменений у части когорты. В некоторых случаях был увеличен интервал между смертью и исследованием. Поскольку посмертный аутолиз снижает чувствительность электронной микроскопии и ПЦР, образцы пациентов, собранные через несколько дней после смерти, могут давать ложноотрицательные результаты. Однако мы смогли обнаружить вирусные частицы и вирусную РНК в образцах спустя 140 ч после смерти (пациент N13). Увеличенные интервалы от момента смерти до исследований не должны быть абсолютным критерием исключения из будущих исследований.
Таким образом, наши результаты показывают центральную роль диффузного повреждения легких по типу альвеолярного повреждения у пациентов с тяжелым течением COVID-19. Микротромбозы и повреждение эндотелия не были столь выражены, как сообщалось в предыдущих исследованиях. Мы обнаружили широкий тропизм для SARS-CoV-2, обнаружив коронавирусоподобные частицы в дыхательной системе, почках и желудочно-кишечном тракте. Наши результаты также поднимают вопрос о том, может ли SARS-CoV-2 вызывать прямое повреждение миокарда и способствует ли прямое поражение лимфоцитов распространению вируса и иммунной дисрегуляции. Полученные данные обеспечивают гистологический контекст для клинических наблюдений и помогают охарактеризовать патофизиологию SARS-CoV-2, что, как мы надеемся, приведет к разработке новых стратегий лечения.
Примечание
Рисунок 1. Легкое с субсегментарной тромбоэмболией легочной артерии (тромбы показаны стрелками) у пациента N12.
Рисунок 2. Патологические изменения в легких при COVID-19 по данным аутопсий
(А) Гиалиновые мембраны у пациента N4. Окраска гематоксилином и эозином; увеличение ×100. (B) Диффузное альвеолярное повреждение, фаза организации у пациента N2. Стрелки указывают на пролиферацию фибробластов. Окраска гематоксилином и эозином; увеличение ×100. (C) Многоядерные гигантские клетки и плеоморфные реактивные пневмоциты у пациента N5. Окраска гематоксилином и эозином; увеличение ×400. (D) Плеоморфные многоядерные гигантские клетки, с положительной реакцией на маркер пневмоцитов TTF-1 и отрицательной реакцией на маркер макрофагов CD68 по данным иммуногистохимии у пациента N5. Увеличение ×600. (E) Периваскулярное лимфоцитарное воспаление у пациента N10. Окраска гематоксилином и эозином; увеличение ×200. (F) Реактивные клетки дыхательных путей и бронхиальный эпителий (обозначены стрелками) с положительной иммуноцитохимической реакцией на спайк-белок SARS-CoV-2 у пациента N10. Подкраска ядер гематоксилином; увеличение × 400. (G) Пневмоциты и альвеолярные макрофаги с положительной иммуноцитохимической реакцией на спайк-белок SARS-CoV-2 у пациента N10. Подкраска ядер гематоксилином; увеличение × 200.
SARS-CoV-2 = коронавирус тяжелого острого респираторного синдрома-2.
Рисунок 3. Поражение органов при COVID-19 по данным аутопсий
(А) Трахея с подслизистым лимфоцитарным воспалением у пациента N8. Окраска гематоксилином и эозином; увеличение × 100. (B) Лимфоциты (левая панель) и подслизистые железы (правая панель) в трахее с положительной реакцией на спайковый белок SARS-CoV-2 у пациента N8. Иммуногистохимия, подкраска ядер гематоксилином; увеличение × 200. (C) Сердце с лимфоцитарным миокардитом и ассоциированным поражением миоцитов у пациента N8. Окраска гематоксилином и эозином; увеличение × 40. (D) Сердце с лимфоцитарным миокардитом и некротизированными миоцитами (показаны стрелкой) у пациента N8. Окраска гематоксилином и эозином; увеличение × 400. (E) Селезенка с уменьшенной белой пульпой у пациента N9. Окраска гематоксилином и эозином; увеличение × 40. Изображение на вставке показывает иммуногистохимическую реакцию на CD45. (F) Эпителий почечных канальцев с положительной реакцией на спайковый белок SARS-CoV-2 у пациента N8. Иммуногистохимия, подкраска ядер гематоксилином; увеличение × 400.
Рисунок 4. Коагулопатия при COVID-19 по данным аутопсий
(A) Тромб малого сосуда у пациента N12. Окраска гематоксилином и эозином; увеличение × 40. (B) Легочный микротромб у пациента N3. Окраска гематоксилином и эозином; увеличение × 200. (C) Легочный микротромб у пациента N8. Окраска гематоксилином и эозином; увеличение × 200. (D) Легочный микротромб у пациента N14. Окраска гематоксилином и эозином; увеличение × 400. (E) Организующийся тромб в почечной вене у пациента N13. Окраска гематоксилином и эозином; увеличение × 40.
Рисунок 5. Ультраструктурные особенности при COVID-19 по данным аутопсий
Обнаружение вирусных частиц методом электронной микроскопии: в эпителиальных клетках трахеи (A и B) у пациента N13, пневмоцитах легких (C и D) у пациента N13, энтероцитах (E и F) у пациента N13, эндотелиальных клетках почек (G) у пациента N8, эпителиальных клетках проксимальных почечных канальцев (H) у пациента N13.
Вирусные частицы (обозначены зелеными стрелками) наблюдались: вне клеток (A и F) в непосредственной близости от клеточной мембраны и внутри клеток (B, C, D, E, G и H) в агрегатах, заключенных в везикулы (обозначены зелеными треугольниками).
Некоторые частицы были связаны с двойными мембранами (обозначены белыми треугольниками), напоминающими везикулы с двойной мембранной оболочкой.
Звездочками на рисунках (A) и (F) отмечены клетки, прилегающие к вирусным частицам во внеклеточном пространстве.
Литература
- Zhu N, Zhang D, Wang W et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020; 382: 727-733 (doi.org)
- Lu R, Zhao X, Li J et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020; 395: 565-574 (doi.org)
- Hoffmann M, Kleine-Weber H, Schroeder S et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020; 181: 271-280 (doi.org)
- Wu Z, McGoogan JM Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA. 2020; 323: 1239-1242 (doi.org)
- Yu F, Yan L, Wang N et al. Quantitative detection and viral load analysis of SARS-CoV-2 in infected patients. Clin Infect Dis. 2020; (doi.org опубликовано 28.03.2020)
- Wang W, Xu Y, Gao R et al. Detection of SARS-CoV-2 in different types of clinical specimens.JAMA. 2020; 323: 1843-1844 (doi.org)
- Ling Y, Xu S-B, Lin Y-X et al. Persistence and clearance of viral RNA in 2019 novel coronavirus disease rehabilitation patients. Chin Med J (Engl). 2020; 133: 1039-104 (doi.org)
- Lee N, Hui D, Wu A et al. A major outbreak of severe acute respiratory syndrome in Hong Kong. N Engl J Med. 2003; 348 :1986-1994 (doi.org)
- Barton LM, Duval EJ, Stroberg E, Ghosh S, Mukhopadhyay S COVID-19 autopsies, Oklahoma, USA. Am J Clin Pathol. 2020; 153: 725-733 (doi.org)
- Tian S, Xiong Y, Liu H et al. Pathological study of the 2019 novel coronavirus disease (COVID-19) through postmortem core biopsies. Mod Pathol. 2020; 33: 1007-1014 (doi.org)
- Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020; 8: 420-422 (doi.org)
- Magro C, Mulvey JJ, Berlin D et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases.Transl Res. 2020; 220: 1-13 (doi.org)
- McMichael TM, Currie DW, Clark S et al. Epidemiology of COVID-19 in a long-term care facility in King County, Washington. N Engl J Med. 2020; 382: 2005-2011 (doi.org)
- Su H, Yang M, Wan C et al. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020; 98: 219-227 (doi.org)
- Varga Z, Flammer AJ, Steiger P et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020; 395: 1417-1418 (doi.org)
- Choi Y, Bowman JW,Jung JU Autophagy during viral infection—a double-edged sword.Nat Rev Microbiol. 2018; 16: 341-354 (doi.org)
- Tian S, Hu W, Niu L, Liu H, Xu H, Xiao S-Y Pulmonary pathology of early-phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer.J Thorac Oncol. 2020; 15: 700-704 (doi.org)
- Gu J, Gong E, Zhang B et al. Multiple organ infection and the pathogenesis of SARS.J Exp Med. 2005; 202: 415-424 (doi.org)
- Nicholls JM, Poon LLM, Lee KC et al. Lung pathology of fatal severe acute respiratory syndrome. Lancet. 2003; 361: 1773-1778 (doi.org)
- Franks TJ, Chong PY, Chui P et al. Lung pathology of severe acute respiratory syndrome (SARS): a study of 8 autopsy cases from Singapore. Hum Pathol. 2003; 34: 743-748 (doi.org)
- Shi H, Han X, Jiang N et al.Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis. 2020;20: 425-434(doi.org)
- Marini JJ, Gattinoni L. Management of COVID-19 respiratory distress.JAMA. 2020; 323: 2329-2330 (doi.org)
- Gattinoni L, Chiumello D, Caironi P et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med. 2020; 46: 1099-1102 (doi.org)
- Goldsmith CS, Miller SE, Martines RB, Bullock HA, Zaki FR Electron microscopy of SARS-CoV-2: a challenging task. Lancet. 2020; 395: e99 (doi.org)
- Arentz M, Yim E, Klaff L et al. Characteristics and outcomes of 21 critically ill patients with COVID-19 in Washington State. JAMA. 2020; 323: 1612-1614 (doi.org)
- Bowles NE, Ni J, Kearney DL et al. Detection of viruses in myocardial tissues by polymerase chain reaction. Evidence of adenovirus as a common cause of myocarditis in children and adults. J Am Coll Cardiol. 2003; 42: 466-472 (doi.org)
- Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004; 203: 631-637 (doi.org)
- Batlle D, Soler MJ, Sparks MA et al. Acute kidney injury in COVID-19: emerging evidence of a distinct pathophysiology. J Am Soc Nephrol. 2020; 31: 1380-1383 (doi.org)
- Wang X, Xu W, Hu G et al. SARS-CoV-2 infects T lymphocytes through its spike protein-mediated membrane fusion. Cell Mol Immunol. 2020; (doi.org опубликовано 7.04.2020)
- Liu J, Li S, Liu J et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients. EBioMedicine. 2020; 55102763 (doi.org)
- Xing Y-H, Ni W, Wu Q et al. Prolonged viral shedding in feces of pediatric patients with coronavirus disease 2019. J Microbiol Immunol Infect. 2020; 53: 473-480 (doi.org)