Эндотелиит, тромбоз и ангиогенез сосудов легких при COVID-19

Оригинал: Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19
Опубликовано: NEJM.org., 21.05.2020
Автор: Maximilian Ackermann, M.D., at al.
Перевод: Фархутдинова Альбина, Фонд профилактики рака
Аннотация
Актуальность исследования
Прогрессирующая дыхательная недостаточность является основной причиной смерти при коронавирусной инфекции (Covid-19). Несмотря на интерес к патофизиологии этого заболевания, относительно мало данных о сопутствующих морфологических и молекулярных изменениях в периферических отделах легких у умерших от Covid-19.
Методы
Мы провели исследование 7 легких, полученных при аутопсии от пациентов, умерших от Covid-19, и сравнили их с 7 легкими от пациентов, умерших от острого респираторного дистресс-синдрома (ОРДС) — осложнения гриппа A(H1N1), и 10 легкими от контрольной группы возрастных пациентов, умерших от неинфекционный причины. Легкие исследованы с использованием иммуногистохимического анализа (с применением 7 цветов), микрокомпьютерной томографии, сканирующей электронной микроскопии, наливки сосудов (инъекционно-коррозионного метода) и прямого мультиплексного анализа экспрессии генов.
Результаты
У пациентов, умерших от респираторной недостаточности, ассоциированной с Covid-19 или гриппом, гистологическая картина в периферическом отделе легких представляла собой диффузное альвеолярное повреждение с периваскулярной Т-клеточной инфильтрацией. В легких у пациентов с Covid-19 также имелись четко выраженные особенности сосудов, заключающиеся в тяжелом эндотелиальном повреждении, связанном с наличием внутриклеточного вируса и нарушением клеточных мембран. Гистологический анализ легочных сосудов у больных Covid-19 показал широкое распространение тромбоза с микроангиопатией. Альвеолярные капиллярные микротромбы были в 9 раз более распространены у пациентов с Covid-19, чем у пациентов с гриппом (Р < 0,001). В легких у больных Covid-19 количество новых растущих сосудов — преимущественно за счет механизма инвагинального ангиогенеза — было в 2,7 раза выше, чем в легких у больных гриппом (Р<0,001)
Заключение
В нашем небольшом исследовании сосудистый ангиогенез отличает легочную патобиологию при Covid-19 и при столь же тяжелом гриппе. Универсальность и клинический подтекст наших наблюдений требуют дальнейших исследований. (Финансируется Национальными институтами здравоохранения и другими организациями).
Введение
Инфекция с тяжелым острым респираторным синдромом коронавирус 2 (SARS-CoV-2) у человека ассоциируется с широким спектром клинических респираторных синдромов, начиная от легких симптомов со стороны верхних дыхательных путей и заканчивая прогрессирующей опасной для жизни вирусной пневмонией [1, 2]. Клинически пациенты с тяжелым течением коронавирусного заболевания (Covid-19) имеют затрудненное дыхание и прогрессирующую гипоксемию и часто переводятся на искусственную вентиляцию легких. Рентгенологически непрозрачные на компьютерной томографии (КТ) грудной клетки периферические отделы легких по типу «матового стекла» соответствуют Берлинским критериям острого респираторного дистресс-синдрома (ОРДС) [3, 4]. Гистологически отличительной чертой ранней фазы ОРДС является диффузное повреждение альвеол с отеком, кровоизлияниями и внутриальвеолярным отложением фибрина, как описано Katzenstein et al [5]. Диффузное поражение альвеол — неспецифический признак, поскольку оно может иметь неинфекционные или инфекционные причины, включая коронавирус ближневосточного респираторного синдрома (БВРС-КоВ)[6], SARS-CoV[7], SARS-CoV-2[8-10] и вирусы гриппа[11].
В числе отличительных особенностей Covid-19 сосудистые изменения, связанные с данным заболеванием. Что касается диффузного повреждения альвеол при SARS-CoV и SARS-CoV-2 [8, 12], то образование фибриновых тромбов наблюдалось в отдельных случаях, но систематически не изучалось. Клинически многие пациенты имеют повышенный уровень Д-димера, а также изменения кожи конечностей, свидетельствующие о тромботической микроангиопатии [13]. Диффузное внутрисосудистое свертывание крови и тромбоз крупных сосудов были связаны с полиорганной недостаточностью [14-16]. Изменения в периферических легочных сосудах хуже описаны; однако васкулопатия в газообменных сетях, в зависимости от ее влияния на соответствие результатов вентиляции и перфузии, потенциально может объяснять гипоксемию и влияние позы (например, прон-позиции) на оксигенацию[17].
Несмотря на предыдущий опыт работы с SARS-CoV [18] и ранний опыт работы с SARS-CoV-2, морфологические и молекулярные изменения, связанные с этими инфекциями в периферических отделах легких, недостаточно хорошо документированы. Здесь мы исследуем морфологические и молекулярные особенности легких, полученных при аутопсии у пациентов, умерших от Covid-19, в сравнении с таковыми у пациентов, умерших от гриппа, и у контрольных пациентов соответствующего возраста, умерших от неинфекционных причин.
Методы
Выборка пациентов и последовательность работы
Мы проанализировали образцы аутопсий легких у семи пациентов, умерших от дыхательной недостаточности, вызванной инфекцией SARS-CoV-2, и сравнили с легкими от семи пациентов, умерших от пневмонии, вызванной вирусом гриппа А подтипа H1N1 (A[H1N1]) — штаммом, ассоциированным с пандемиями гриппа 1918 и 2009 годов. Легкие пациентов с гриппом были выбраны с соответствием по возрасту, полу и тяжести заболевания из числа аутопсий, проведенных в Ганноверской медицинской школе, и сохраненных со времен пандемии 2009 года. Десять донорских легких, не использованных для трансплантации, послужили неинфицированными контрольными образцами.
В группу Covid-19 входили 2 женщины и 5 мужчин со средним возрастом (± SD) 68 ± 9,2 года и 80 ± 11,5 лет соответственно (клинические данные приведены в таблице S1A в дополнительном приложении, доступном с полным текстом данной статьи по адресу: NEJM.org). Группа больных гриппом состояла из 2 женщин и 5 мужчин со средним возрастом 62,5 ± 4,9 года и 55,4 ± 10,9 года соответственно. Пять неинфицированных легких были получены от доноров-женщин (средний возраст — 68,2 ± 6,9 года) и пять от доноров-мужчин (средний возраст — 79,2 ± 3,3 года) (клинические данные приведены в таблице S1B). Исследование было одобрено и проведено в соответствии с требованиями комитета по этике Ганноверской медицинской школы и Левенского Университета. Проводилось без коммерческой поддержки.
Все легкие всесторонне проанализировали с использованием микроКТ, гистопатологического и мультиплексного иммуногистохимического анализа, трансмиссионной и сканирующей электронной микроскопии, наливки сосудов и прямого мультиплексного анализа экспрессии генов, более подробное описание в разделе «методы» дополнительного приложения.
Статистический анализ
Все сравнения числовых переменных (в том числе и в анализе экспрессии генов) проводились с использованием T-критерия Стьюдента для оценки частоты ошибок из-за кратности, установленной на уровне 0,05, с использованием метода Бенжамини–Хохберга для контроля FDR (ожидаемой доли ложных отклонений среди всех отклоненных гипотез). Исходные значения P сообщаются только для тестов, удовлетворяющих критериям FDR (доли ложных отклонений гипотез). Все доверительные интервалы были рассчитаны также на основе t-распределения. Дополнительные сведения приводятся в разделе «методы» дополнительного приложения.
Результаты
Макроскопическое исследование
Средняя (± SE) масса легких у пациентов с доказанной гриппозной пневмонией была достоверно выше, чем у пациентов с доказанной Covid-19 (2404 ± 560 г и 1681 ± 49 г; р = 0,04). Средняя масса неинфицированных контрольных легких (1045 ± 91 г) была достоверно ниже, чем в группе гриппа (Р = 0,003) и группе Covid-19 (Р < 0,001).
Ангиоцентрическое воспаление
Во всех образцах легких из группы Covid-19 имелось диффузное альвеолярное повреждение с некрозом клеток альвеолярной выстилки, гиперплазией пневмоцитов 2 типа и линейным внутриальвеолярным отложением фибрина (рис. 1).
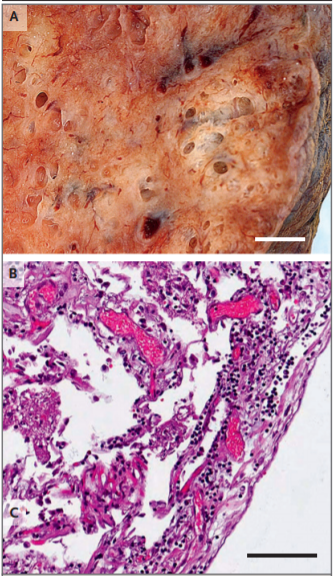
Рисунок 1. Лимфоцитарное воспаление в легком от пациента, который умер от Covid-19.
Макрофотография внешнего вида легкого от пациента, умершего от Covid-19, показана на панели A (шкала соответствует 1 см). При гистопатологическом исследовании, представленном на панели В, была выявлена интерстициальная и периваскулярная преимущественно лимфоцитарная пневмония с мультифокальным эндотелиитом (окрашивание гематоксилин–эозином; шкала соответствует 200 мкм).
В четырех из семи случаев изменения были очаговыми, с незначительным интерстициальным отеком. Остальные три случая имели однородные отложения фибрина и выраженный интерстициальный отек с ранней интраальвеолярной организацией. Образцы в группе гриппа имели ярко выраженное диффузное альвеолярное повреждение с массивным интерстициальным отеком и обширным отложением фибрина во всех случаях. Кроме того, в трех образцах в группе гриппа было воспаление с фокальным рубцеванием и резорбцией (рис. S2). Эти изменения привели к значительно большей массе легких у больных гриппом.
Иммуногистохимический анализ экспрессии ангиотензин-превращающего фермента 2 (АПФ2), определяемый как средний (± SD) относительный подсчет АПФ2-позитивных клеток в поле зрения, в неинфицированных контрольных легких показал незначительную экспрессию АПФ2 в альвеолярных эпителиальных клетках (0.053 ± 0,03) и капиллярных эндотелиальных клетках (0.066 ± 0.03). В легких больных Covid-19 и легких больных гриппом относительное количество АПФ2-позитивных клеток в поле зрения составило 0,25 ± 0,14 и 0,35 ± 0,15 соответственно для клеток альвеолярного эпителия и 0,49 ± 0,28 и 0,55 ± 0,11 для эндотелиальных клеток. Кроме того, АПФ2-положительные лимфоциты не были обнаружены в периваскулярной ткани или в альвеолах контрольных легких, но присутствовали в легких в группе Covid-19 и группе гриппа (относительные показатели 0,22±0,18 и 0,15±0,09 соответственно). (Подробности подсчета приведены в таблице S2)
В легких у больных Covid-19 и больных гриппом было обнаружено одинаковое среднее (± SD) количество CD3+ Т-клеток в радиусе 200 мкм от стенок прекапиллярных и посткапиллярных сосудов в 20 полях исследования на одного пациента (26,2 ± 13,1 для Covid-19 и 14,8 ± 10,8 для гриппа). При одинаковом размере поля, использованного для исследования, CD4+ Т-клетки были в большем количестве в легких у больных Covid-19, чем в легких у больных гриппом (13,6 ± 6,0 и 5,8 ± 2,5, р = 0,04), тогда как CD8+ Т-клетки были в меньшем количестве (5,3 ± 4,3 и 11,6 ± 4,9, Р = 0,008). Нейтрофилы (CD15+) были в значительно меньшем количестве рядом с альвеолярной эпителиальной выстилкой в группе Covid-19, чем в группе гриппа (0,4 ± 0,5 и 4,8 ±5,2, Р = 0,002).
Мультиплексный анализ экспрессии генов, связанных с воспалением, среди 249 генов из панели воспаления nCounter (NanoString Technologies) выявил сходство и различия между образцами в группе Covid-19 и образцами в группе гриппа. В общей сложности 79 генов, связанных с воспалением, были дифференциально регулируемы только в образцах от пациентов с Covid-19, в то время как 2 гена были дифференциально регулируемы только в образцах от пациентов с гриппом; общий паттерн экспрессии был обнаружен для 7 генов (рис. S1).
Тромбоз и микроангиопатия
Легочную сосудистую систему легких в группе Ковид-19 и группе гриппа анализировали с помощью гематоксилин-эозина, трихрома и иммуногистохимического окрашивания (как описано в разделе «методы» дополнительного приложения). Анализ прекапиллярных артериол показал, что в четырех из семи легких у больных Covid-19 и четырех из семи легких у больных грриппом тромбы одинаково присутствовали в легочных артериях диаметром от 1 мм до 2 мм, без полной обструкции просвета сосудов (рис. S3 и S5). Фибриновые тромбы альвеолярных капилляров наблюдались во всех легких у обеих групп больных (ис. 2).
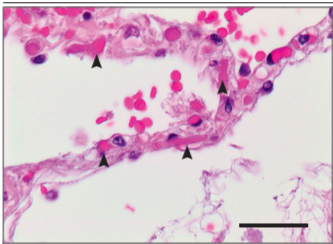
Рисунок 2. Микротромбы в межальвеолярных перегородках легкого у пациента, умершего от Covid-19.
Межальвеолярная перегородка этого пациента (Пациент 4 в таблице S1A в дополнительном приложении) показывает слегка расширенные альвеолярные стенки с множественными фибринозными микротромбами (указано стрелками) в альвеолярных капиллярах. В интраальвеолярном пространстве видны экстравазальные эритроциты и рыхлая сеть фибрина (окрашивание гематоксилин-эозином; шкала соответствует 50 мкм).
Альвеолярные капиллярные микротромбы были в 9 раз более распространены у пациентов с Covid-19, чем у пациентов с гриппом (среднее [± SD] количество отчетливых тромбов на квадратный сантиметр площади просвета сосудов — 159 ± 73 и 16 ± 16 соответственно; Р = 0,002). Внутрисосудистые тромбы в посткапиллярных венулах диаметром менее 1 мм наблюдались в меньшем количестве в легких у больных Covid-19, чем у больных гриппом (12 ± 14 против 35 ± 16, Р = 0,02). В группе Covid-19 все сегменты сосудистой сети были вовлечены в двух легких, а в группе гриппа в четырех; в трех легких в группе Covid-19 и трех легких в группе гриппа были обнаружены комбинированные капиллярные и венозные тромбы без артериальных тромбов.
Гистологические данные подтверждались трехмерной микроКТ легочных образцов: в легких больных Covid-19 и больных гриппом наблюдались почти полные окклюзии прекапиллярных и посткапиллярных сосудов.
Ангиогенез
Мы исследовали микрососудистую архитектуру легких у больных Covid-19, у больных гриппом и неинфицированных контрольных пациентов с использованием сканирующей электронной микроскопии и микрососудистого метода наливки сосудов (инъекционно-коррозионного метода). Легкие в группе Covid-19 имели нарушенную васкуляризацию со структурно деформированными капиллярами (рис. 3). Удлиненные капилляры в легких у пациентов с Covid-19 свидетельствовали о резких изменениях калибра и наличии инвагинационных столбиков внутри капилляров (рис. 3С). Трансмиссионная электронная микроскопия эндотелия при Covid-19 показала ультраструктурное повреждение эндотелия, а также наличие внутриклеточного SARS-CoV-2 (ис. 3D). Вирус также может быть идентифицирован во внеклеточном пространстве.
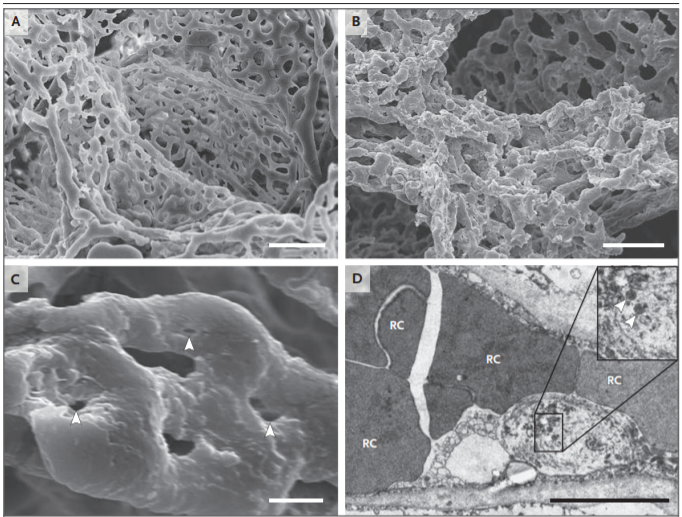
Рисунок 3. Микрососудистые изменения в легких у пациентов, умерших от Covid-19.
На панелях А и B показаны сделанные с помощью сканирующего электронного микроскопа микрофотографии микрососудистых коррозийных слепков (полученных путем наливки сосудов) из тонкостенного альвеолярного сплетения здорового легкого (панель A) и существенные архитектурные нарушения, наблюдаемые в легких, поврежденных при Covid-19 (панель B). Потеря четко видимой иерархии сосудов в альвеолярном сплетении является следствием образования новых кровеносных сосудов в результате инвагинального ангиогенеза. Панель C показывает локализацию инвагинального столбика (указано стрелками) при более высоком увеличении. Панель D представляет собой трансмиссионную электронную микрофотографию, показывающую ультраструктурные особенности деструкции эндотелиальных клеток и SARS-CoV-2, видимые внутри клеточной мембраны (указано стрелками) (шкала соответствует 5 мкм).
В легких у больных Covid-19 плотность признаков инвагинального ангиогенеза (среднее значение [± SE], 60,7 ± 11,8 признаков на поле) была достоверно выше, чем в легких у больных гриппом (22,5 ± 6,9) или в неинфицированных контрольных легких (2,1 ± 0,6) (Р < 0,001 для обоих сравнений) (рис.1). 4А). Плотность признаков прорастающего ангиогенеза также была выше в группе Covid-19, чем в группе гриппа (Рис. 4B). При построении графика количества легочных ангиогенных признаков в зависимости от продолжительности пребывания в стационаре было обнаружено, что степень инвагинального ангиогенеза достоверно возрастает с увеличением продолжительности госпитализации (Р < 0,001) (рис.4С). В отличие от этого, в легких у больных гриппом было меньше инвагинального ангиогенеза и его количество не увеличивалось с течением времени (рис. 4С). Аналогичная картина наблюдалась и для прорастающего ангиогенеза (рис. 4D).
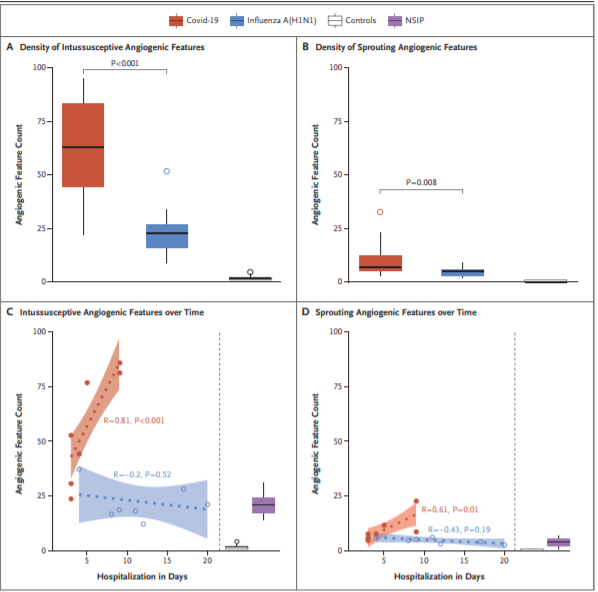
Рис. 4 Численная плотность признаков инвагинального и прорастающего ангиогенеза в легких у больных, умерших от Covid-19 или гриппа А (H1N1).
Признаки прорастающего и инвагинального ангиогенеза учитывались в поле зрения при помощи микрососудистого метода коррозийных слепков. В легких у больных Covid-19 (красный цвет), легких у больных гриппом А(H1N1) (синий цвет) и контрольных легких (белый цвет). На панелях A и B числовые плотности признаков ангиогенеза суммируются в виде коробчатых графиков для инвагинального и прорастающего ангиогенеза. Боксы отражают межквартильный диапазон, а диаграмма размаха указывает на этот диапазон (до 1,5 раз превышающий межквартильный диапазон). Выпадения за линии обозначаются обособленными точками. Статистическое сравнение легких пациентов Covid-19 и легких пациентов с гриппом и неинфицированными контрольными легкими показало достоверно более высокую частоту ангиогенеза у пациентов с Covid-19, особенно инвагинального ангиогенеза (значения Р рассчитывались с помощью t-критерия Стьюдента, контролируемого для частоты ошибок с порогом ожидаемой доли ложных отклонений Бенджамини-Хохберга (FDR) 0,05). На панелях С и D показано хронологическое сравнение инвагинального и прорастающего ангиогенеза в легких у пациентов с Covid-19 и легких у пациентов с гриппом А (H1N1), в зависимости от продолжительности госпитализации. Данные числа являются коэффициентами корреляции Пирсона и значениями Р (Все отображаемые значения Р 0,05 или ниже также проходят порог FDR 0,05). Медиана количества признаков ангиогенеза для каждого пациента отображается в виде одной точки. Заштрихованные области, охватывающие пунктирные линии линейной регрессии, сглаживаются 95 % доверительными интервалами. В качестве эталона для повышенного образования кровеносных сосудов при заболеваниях легких показаны инвагинальный и прорастающий ангиогенез, обнаруженный при терминальной неспецифической интерстициальной пневмонии (НСИП), хроническом интерстициальном заболевании легких, во время трансплантации легких (в среднем 1650 дней от первой консультации до трансплантации легких) (фиолетовые квадраты). Результаты исследования в здоровых контрольных легких также показаны (графики белого квадрата). Белые и фиолетовые квадраты отображаются относительно оси y, но не оси x (как показано вертикальными пунктирными линиями).
Мультиплексный анализ экспрессии генов, связанных с ангиогенезом (323 гена из панели Ncounter Pancancer Progression Panel (NanoString Technologies)), выявил различия между образцами от пациентов с Covid-19 и больных гриппом. В общей сложности 69 генов, связанных с ангиогенезом, были дифференциально регулируемы только в группе Covid-19, по сравнению с 26 генами, дифференциально регулируемыми только в группе гриппа; 45 генов имели общие изменения в экспрессии (рис. 5).
Рисунок 5. Анализ относительной экспрессии генов, ассоциированных с ангиогенезом, в легких у пациентов, умерших от Covid-19 или гриппа А (H1N1).
РНК была выделена из срезов, которые использовались для комплементарного гистологического и иммуногистохимического анализа. РНК выделяли с помощью системы экстракции РНК Максвелла (Promega) и после контроля качества с помощью кубит-анализа (ThermoFisher) использовали для дальнейшего анализа. Во время процедуры NanoString отдельные копии всех молекул РНК маркировались геноспецифическими штрихкодами и подсчитывались индивидуально с помощью аналитической системы nCounter (NanoString Technologies). Экспрессия генов, ассоциированных с ангиогенезом, была измерена с помощью панели NanoString nCounter Pancancer Progression panel (323 целевых гена, аннотированных как релевантные для ангиогенеза). Полученные данные экспрессии генов были нормализованы на отрицательные контрольные полосы (вычитание среднего арифметического фона), положительные контрольные полосы (коэффициент нормализации среднего геометрического значения) и все эталонные гены, присутствующие на панели (коэффициент нормализации среднего геометрического значения), с использованием программного обеспечения Nsolver Analysis версии 4.0. На диаграмме Венна показаны только гены, которые статистически дифференциально экспрессируются по сравнению с экспрессией в контроле в обеих группах заболеваний (t-критерий Стьюдента, контролируемый для частоты ошибок с порогом FDR Бенджамини–Хохберга 0,05). Восходящая регуляция и нисходящая регуляция генов обозначаются цветными стрелками, прикрепленными к символам генов (фиолетовый обозначает восходящую регуляцию, красный — нисходящую регуляцию).
Обсуждение
В этом исследовании мы изучили морфологические и молекулярные особенности семи легких, полученных при аутопсии от пациентов, умерших от инфекции SARSCoV-2. Легкие этих пациентов сравнивали с легкими пациентов, умерших от ОРДС, развившегося как осложнение гриппа А(H1N1), и от неинфицированной контрольной группы. Легкие у больных Covid-19 и больных гриппом имели общую морфологическую картину диффузного поражения альвеол и периваскулярной лимфоцитарной инфильтрации. В легких больных Covid-19 было три отличительных ангиоцентрических признака. Во-первых, тяжелое повреждение эндотелия, связанное с внутриклеточным расположением вируса SARS-CoV-2 и разрушением мембран эндотелиальных клеток. Во-вторых, легкие у больных Covid-19 имели распространенный сосудистый тромбоз с микроангиопатией и окклюзией альвеолярных капилляров [12, 19]. В-третьих, в легких пациентов с Covid-19 имелся значительный рост новых сосудов за счет механизма инвагинального ангиогенеза. Хотя наша выборка была небольшой, выявленные нами сосудистые особенности согласуются с наличием отличительных легочных сосудистых патобиологических особенностей в некоторых случаях Covid-19.
Обнаруженный нами усиленный инвагинальный ангиогенез в легких у больных Covid-19 по сравнению с легкими у больных гриппом был неожиданным. Рост новых сосудов может происходить путем обычного прорастания или инвагинального (непрорастающего) ангиогенеза. Характерная особенность инвагинального ангиогенеза — наличие столбика, внедряющегося в просвет вдоль сосуда [20]. Обычно называемая инвагинальным столбом, эта выстланная эндотелием внутрисосудистая структура не видна при световой микроскопии, но легко идентифицируется с помощью метода наливки сосудов и сканирующей электронной микроскопии [21]. Хотя тканевая гипоксия, вероятно, была общей чертой в легких у обеих этих групп пациентов, мы предполагаем, что большая степень эндотелиита и тромбоза в легких у пациентов с Covid-19 может способствовать относительно более высокой частоте прорастания и инвагинального ангиогенеза, наблюдаемого у этих пациентов. Связь этих результатов с клиническим течением Covid-19 требует дальнейших исследований для уточнения.
Основным ограничением нашего исследования является то, что выборка была небольшой; мы изучили только 7 пациентов из более чем 320 000 человек, умерших от Covid-19, и данные вскрытия также представляют собой статическую информацию. На основании имеющихся данных мы не можем реконструировать сроки наступления смерти в контексте развивающегося процесса заболевания. Кроме того, могут существовать и другие факторы, объясняющие различия, которые мы наблюдали между пациентами с Covid-19 и больными гриппом. Например, ни один из пациентов в нашем исследовании, умерших от Covid-19, не получал стандартной искусственной вентиляции легких, в то время как пять из семи пациентов, умерших от гриппа, получали искусственную вентиляцию легких под контролем давления. Аналогичным образом, вполне возможно, что различия в обнаруживаемом инвагинальном ангиогенезе могут быть обусловлены различиями во времени течения Covid-19 и гриппа. Эти и другие неизвестные факторы необходимо учитывать при оценке наших данных [22]. Тем не менее, наш анализ показывает, что такая возможность маловероятна, тем более что степень инвагинального ангиогенеза у больных Covid-19 значительно повышалась с увеличением продолжительности госпитализации, тогда как у больных гриппом она оставалась стабильной на значительно более низком уровне. Более того, мы показали, что инвагинальный ангиогенез является преобладающим ангиогенным механизмом даже на поздних стадиях хронического повреждения легких [21].
АПФ2 — это интегральный мембранный белок, который является рецептором клетки-хозяина для SARSCoV-2 [23, 24]. Наши данные показали значительно большее количество АПФ2-положительных клеток в легких у пациентов с Covid-19 и у пациентов с гриппом, чем у неинфицированных контрольных групп. Мы обнаружили большее количество АПФ2-положительных эндотелиальных клеток и значительные изменения в морфологии эндотелия, что согласуется с центральной ролью эндотелиальных клеток в сосудистой фазе Covid-19. Эндотелиальные клетки в образцах от пациентов с Covid-19 показали нарушение межклеточных соединений, набухание клеток и потерю контакта с базальной мембраной. Наличие вируса SARS-CoV-2 в эндотелиальных клетках, находка, согласующаяся с другими исследованиями [25], предполагает, что прямые вирусные эффекты, а также периваскулярное воспаление могут способствовать повреждению эндотелия.
Мы сообщили о наличии легочного инвагинального ангиогенеза и других легочных сосудистых особенностей в легких у семи пациентов, умерших от Covid-19. Необходимо дополнительное исследование, чтобы соотнести наши результаты с клиническим течением заболевания. Чтобы помочь другим в их исследованиях, наш полный набор данных доступен на платформе Vivli и может быть запрошен с использованием следующего цифрового идентификатора объекта: doi.org.
Список литературы:
- Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020;382:727-733.
- Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020;395:507-513.
- Raptis CA, Hammer MM, Short RG, et al. Chest CT and coronavirus disease (COVID-19): a critical review of the literature to date. AJR Am J Roentgenol 2020 April 16 (Epub ahead of print).
- Thompson BT, Chambers RC, Liu KD. Acute respiratory distress syndrome. N Engl J Med 2017;377:562-572.
- Katzenstein AL, Bloor CM, Leibow AA. Diffuse alveolar damage — the role of oxygen, shock, and related factors: a review. Am J Pathol 1976;85:209-228.
- Alsaad KO, Hajeer AH, Al Balwi M, et al. Histopathology of Middle East respiratory syndrome coronovirus (MERS-CoV) infection — clinicopathological and ultrastructural study. Histopathology 2018;72:516-524.
- Nicholls JM, Poon LLM, Lee KC, et al. Lung pathology of fatal severe acute respiratory syndrome. Lancet 2003;361:1773-1778.
- Barton LM, Duval EJ, Stroberg E, Ghosh S, Mukhopadhyay S. COVID-19 autopsies, Oklahoma, USA. Am J Clin Pathol 2020;153:725-733.
- Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY. Pulmonary pathology of early-phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol 2020;15:700-704.
- Menter T, Haslbauer JD, Nienhold R, et al. Post-mortem examination of COVID19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings of lungs and other organs suggesting vascular dysfunction. Histopathology 2020 May 4 (Epub ahead of print).
- Voltersvik P, Aqrawi LA, Dudman S, et al. Pulmonary changes in Norwegian fatal cases of pandemic influenza H1N1 (2009) infection: a morphologic and molecular genetic study. Influenza Other Respir Viruses 2016;10:525-531.
- Magro C, Mulvey JJ, Berlin D, et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases. Transl Res 2020 April 15 (Epub ahead of print).
- Liu PP, Blet A, Smyth D, Li H. The science underlying COVID-19: implications for the cardiovascular system. Circulation 2020 April 15 (Epub ahead of print).
- Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost 2020;18:1094-1099.
- Zhu J, Ji P, Pang J, et al. Clinical characteristics of 3,062 COVID-19 patients: a meta-analysis. J Med Virol 2020April 15 (Epub ahead of print).
- Porfidia A, Pola R. Venous thromboembolism in COVID-19 patients. J Thromb Haemost 2020 April 15 (Epub ahead of print).
- Scholten EL, Beitler JR, Prisk GK, Malhotra A. Treatment of ARDS with prone positioning. Chest 2017;151:215-224.
- Gu J, Gong E, Zhang B, et al. Multiple organ infection and the pathogenesis of SARS. J Exp Med 2005;202:415-424.
- O’Donnell J, Sharif K, Emery P, Bridgewood C. McGonagle D. Why the immune mechanisms of pulmonary intravascular coagulopathy in COVID-19 pneumonia are distinct from macrophage activation syndrome with intravascular coagulation. April 2020(researchgate.net).
- Mentzer SJ, Konerding MA. Intussusceptive angiogenesis: expansion and remodeling of microvascular networks. Angiogenesis 2014;17:499-509.
- Ackermann M, Stark H, Neubert L, et al. Morphomolecular motifs of pulmonary neoangiogenesis in interstitial lung diseases. Eur Respir J 2020;55(3):1900933-1900933.
- Buja LM, Wolf D, Zhao B, et al. Emerging spectrum of cardiopulmonary pathology of the coronavirus disease 2019 (COVID-19): report of three autopsies from Houston, Texas and review of autopsy findings from other United States cities. May 7, 2020 (sciencedirect.com). preprint.
- Hoffmann M, Kleine-Weber H, Krueger N, Mueller MA, Drosten C, Poehlmann S. The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular protease TMPRSS2 for entry into target cells. January 31, 2020 (biorxiv.org). preprint.
- Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science 2020;367:1444-1448.
- Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet 2020;395:1417-1418.