Диагностика, лечение и патофизиология артериального и венозного тромбоза при COVID-19

Оригинал: JAMA Network
Автор: Gregory Piazza et al.
Опубликовано: 23 ноября 2020, JAMA Network
Перевод: Анна Селюта, Фонд медицинских решений «Не напрасно!»
Редакция: Дарья Цыба, Фонд медицинских решений «Не напрасно!»
Как часто возникают тромбоэмболические осложнения (ТЭО) при COVID-19?
В американском реестре пациентов с коронавирусной болезнью 2019 (COVID-19) тромботические осложнения возникли у 2,6% из 229 госпитализированных пациентов в некритическом состоянии и у 35,3% из 170 госпитализированных пациентов в критическом состоянии [1]. Риск тромбоэмболии при инфекции SARS-CoV-2 у негоспитализированных пациентов неизвестен.
Что включают в себя тромбоэмболические осложнения при COVID-19?
Тромбоэмболические осложнения включают инфаркт миокарда (ИМ), ишемический инсульт и венозную тромбоэмболию (ВТЭ). По результатам вскрытий микротромбы обнаруживаются во многих системах органов, включая легкие, сердце и почки, что позволяет предположить, что тромбоз может способствовать мультисистемной дисфункции органов при тяжелой форме COVID-19 [2].
Какова патофизиология ТЭО?
Хотя патофизиология полностью не определена, у пациентов с COVID-19 были выявлены протромботические нарушения.
Авторы приводят данные различных клинических исследований, на основании которых они предполагают уникальные патофизиологические механизмы развития ТЭО при COVID-19 (прим. перев.).
Какие изменения были выявлены в биохимических показателях крови?
В исследовании 19 тяжелобольных пациентов с COVID-19 были выявлены повышенные уровни следующих маркеров гиперкоагуляции: D-димера у 100% пациентов, фибриногена у 74% и фактора VIII у 100% пациентов [3]. Антифосфолипидные антитела были обнаружены у 53% участников исследования, а снижение уровня протеина C, протеина S и антитромбина было обнаружено у всех участников [3]. Нарушения коагуляции были ассоциированы с инсультом, ишемией периферических артерий и ВТЭ [3].
Какие изменения наблюдались в тромбоцитарном звене гемостаза?
Исследование 115 пациентов с COVID-19 (71 с нетяжелым и 44 с тяжелым течением заболевания) задокументировало наличие РНК SARS-CoV-2 в тромбоцитах и высокий уровень цитокинов, связанных с тромбоцитами [4]. В этом исследовании агрегация тромбоцитов происходила при более низких, чем ожидалось, концентрациях тромбина [4].
Гистологическое исследование материалов 38 вскрытий пациентов с COVID-19 продемонстрировало микрососудистые тромбы, внеклеточные ловушки нейтрофилов (сети внеклеточной ДНК, выбрасываемой нейтрофилами) и агрегаты нейтрофилов и тромбоцитов [5]. Анализы in vitro, проведенные на образцах периферической крови 3 пациентов с COVID-19, продемонстрировали чрезмерную активацию тромбоцитов и нейтрофилов, оцененную по дегрануляции и активации интегрина IIb-IIIa и иммунофлуоресцентным методом, по сравнению с образцами крови 5 здоровых пациентов из контрольной группы [5].
Что отличает патофизиологию эмболии при COVID-19 от ТЭО при других состояниях?
Прямая вирусная инфекция эндотелиальных клеток с плотной периваскулярной Т-клеточной инфильтрацией наряду с аберрантной активацией макрофагов, гибелью эндотелиальных и воспалительных клеток, тромботической микроангиопатией и ангиогенезом дополнительно отличают COVID-19 гистопатологически от изменений при инфицирования другими респираторными вирусами [6]. Патофизиология тромбоэмболии при COVID-19 по сравнению с заболеваниями, не связанными с COVID-19, может быть более зависимой от тромбоцитов и связанной с вирус-опосредованным эндотелиальным воспалением, в дополнение к гиперкоагуляции, связанной с повышенными концентрациями факторов свертывания, приобретенными антифосфолипидными антителами и снижением концентрации эндогенных белков-антикоагулянтов.
Как тяжесть течения COVID-19 и дыхательная недостаточность влияют на вероятность развития ТЭО?
Более тяжелое системное воспаление и респираторная недостаточность при COVID-19 связаны с более высокой распространенностью тромботических осложнений. Среди 388 пациентов, госпитализированных с COVID-19 (16% были в критическом состоянии), несмотря на тромбопрофилактику низкомолекулярным гепарином (НМГ), у всех пациентов в отделении интенсивной терапии и у 75% из тех, кто не находился в отделении интенсивной терапии, симптомная ВТЭ произошла в 4,4% случаев, ишемический инсульт - 2,5%, ИМ - 1,1% случаев [7].
Увеличивает ли COVID-19 риск ТЭО?
Насколько инфицирование SARS-CoV-2 увеличивает риск тромбоэмболии, неясно. В проведенном в Великобритании исследовании 1877 госпитализированных пациентов с COVID-19 и 18 159 случаев других заболеваний не было выявлено различий в частоте внутригоспитальной ВТЭ (4,8 / 1000 против 3,1 / 1000; отношение шансов 1,6 [ 95% CI, 0,77-3,1]; P = 0,20) [8]. Высокая частота ВТЭ при COVID-19 может быть не столько специфичной для вируса, сколько связанной с общей тяжестью заболевания и наличием осложнений.
Какие рекомендации по профилактике ТЭО при COVID-19 существуют на данный момент?
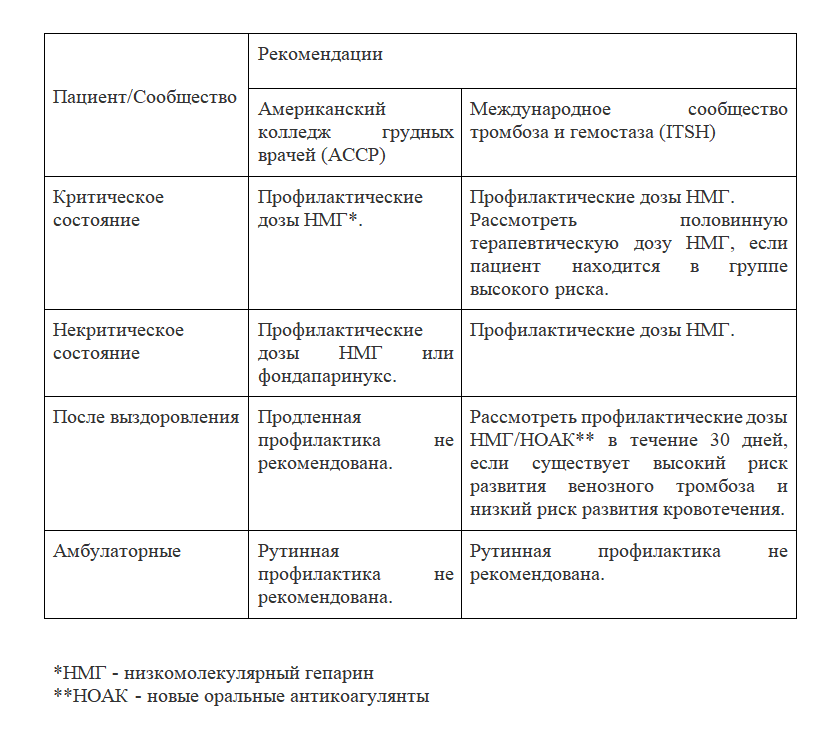
В ожидании завершения текущих испытаний рекомендации по COVID-19 основаны на рекомендациях для людей с другими заболеваниями (таблица). Остается неясным, являются ли эти рекомендации оптимальными для тромбоза, связанного с COVID-19. Рекомендации Американского колледжа пульмонологов (ACCP) предлагают профилактику с помощью НМГ или фондапаринукса вместо нефракционированного гепарина или прямых пероральных антикоагулянтов (НОАК) для всех госпитализированных пациентов с COVID-19 при отсутствии противопоказаний, таких как активное кровотечение [9]. Инъекционные препараты НМГ, вводимые один раз в сутки (40 мг) и фондапаринукс (2,5 мг) предпочтительнее нефракционированного гепарина (2–3 раза в день), поскольку ограничивают контакт медперсонала с инфицированными пациентами. Эти препараты предпочтительнее НОАК из-за отсутствия лекарственного взаимодействия с противовирусными средствами. Хотя были предложены двойные дозы или терапевтические дозы НМГ, учитывая высокую частоту ВТЭ, несмотря на стандартную тромбопрофилактику у тяжелобольных пациентов с COVID-19, ACCP предлагает стандартные дозы НМГ на основании отсутствия данных клинических испытаний [9]. Руководство Международного общества по тромбозу и гемостазу (ISTH) предполагает, что половинную терапевтическую дозу НМГ (1 мг / кг в день) можно рассматривать для профилактики у пациентов с высоким риском ТЭО при COVID-19 и что увеличенная на 50% доза может быть рассмотрена у пациентов с ожирением; однако оптимальная профилактическая терапия остается неясной [10]. Полная доза антитромботической терапии в качестве профилактики для пациентов из группы высокого риска с COVID-19 оценивается в клинических испытаниях (таблица «e» в приложении). Хотя патофизиология тромбоэмболии при COVID-19 включает гиперреактивность тромбоцитов, оценка эффективности антиагрегантной терапии для профилактики ТЭО продолжается.
Нужно ли проводить тромбопрофилактику?
Риск ВТЭ сохраняется после выписки у пациентов из группы высокого риска, госпитализированных по поводу COVID-19 [10]. Однако ACCP не рекомендует проводить тромбопрофилактику после выписки[9].ISTH, напротив, рекомендует проводить тромбопрофилактику после выписки с помощью НМГ или НОАК для всех госпитализированных пациентов с высоким риском ТЭО и COVID-19, которые имеют низкий риск кровотечения[10]. Факторы высокого риска ТЭО при COVID-19 включают возраст старше 65 лет, критическое состояние, онкологические заболевания, предшествующую ВТЭ, тромбофилию, тяжелую неподвижность и повышенный уровень D-димера (более чем в 2 раза превышает верхний предел нормы) [10]. ISTH предлагает проводить тромбопрофилактику в течение 14—30 дней после выписки, хотя оптимальная продолжительность остается неясной. Тромбопрофилактика для пациентов, не нуждающихся в госпитализации, в настоящее время не рекомендуется.
Каковы методы диагностики ТЭО?
Учитывая отсутствие убедительных доказательств пользы, рутинное ультразвуковое исследование для диагностики ВТЭ не рекомендуется [9, 10]. Пациенты с COVID-19, у которых диагностирован артериальный или венозный тромбоз, должны лечиться в соответствии с действующими рекомендациями, с учетом практических преимуществ НМГ в стационарных условиях и НОАК в амбулаторных условиях [10]. В настоящее время ни ISTH, ни ACCP не рекомендуют измерять D-димер для скрининга ВТЭ или для определения интенсивности профилактики или лечения [9, 10].
Каковы общие рекомендации по ТЭО при COVID-19?
Артериальный и венозный тромбоз распространены при COVID-19, особенно у пациентов в критическом состоянии. Для всех госпитализированных пациентов с COVID-19 следует рассмотреть возможность проведения тромбопрофилактики при отсутствии противопоказаний. Текущее исследование позволит определить оптимальные схемы профилактики ТЭО при COVID-19 в отделении интенсивной терапии, при выписке из больницы и у негоспитализированных пациентов с высоким риском тромбоза.
Таблица. Текущие рекомендации по профилактике венозной тромбоэмболии у госпитализированных пациентов с COVID-2019
Источники:
- Piazza G, Campia U, Hurwitz S, et al. Registry of arterial and venous thromboembolic complications in patients with COVID-19. J Am Coll Cardiol. 2020;76(18):2060-2072. dx.doi.org
- Fox SE, Akmatbekov A, Harbert JL, Li G, Quincy Brown J, Vander Heide RS. Pulmonary and cardiac pathology in African American patients with COVID-19: an autopsy series from New Orleans. Lancet Respir Med. 2020;8(7):681-686. dx.doi.org
- Zhang Y, Cao W, Jiang W, et al. Profile of natural anticoagulant, coagulant factor and anti-phospholipid antibody in critically ill COVID-19 patients. J Thromb Thrombolysis. 2020;50(3):580-586. dx.doi.org
- Zaid Y, Puhm F, Allaeys I, et al. Platelets can associate with SARS-Cov-2 RNA and are hyperactivated in COVID-19. Circ Res. 2020. dx.doi.org
- Nicolai L, Leunig A, Brambs S, et al. Immunothrombotic dysregulation in COVID-19 pneumonia is associated with respiratory failure and coagulopathy. Circulation. 2020;142(12):1176-1189. dx.doi.org
- Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120-128. dx.doi.org
- Lodigiani C, Iapichino G, Carenzo L, et al; Humanitas COVID-19 Task Force. Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan, Italy. Thromb Res. 2020;191:9-14. dx.doi.org
- Roberts LN, Whyte MB, Georgiou L, et al. Postdischarge venous thromboembolism following hospital admission with COVID-19. Blood. 2020;136(11):1347-1350. dx.doi.org
- Moores LK, Tritschler T, Brosnahan S, et al Prevention, diagnosis and treatment of venous thromboembolism in patients with COVID-19: CHEST Guideline and Expert Panel Report. Chest. 2020;158:1143-1163. dx.doi.org
- Spyropoulos AC, Levy JH, Ageno W, et al; Subcommittee on Perioperative, Critical Care Thrombosis, Haemostasis of the Scientific, Standardization Committee of the International Society on Thrombosis and Haemostasis. Scientific and Standardization Committee communication: Clinical guidance on the diagnosis, prevention, and treatment of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haemost. 2020;18(8):1859-1865. dx.doi.org